బేరియం క్లోరైడ్
బేరియం క్లోరైడ్ ఒక రసాయన సమ్మేళనం.ఇది ఒక అకర్బన రసాయన సమ్మేళన పదార్థం.
| |

| |
| పేర్లు | |
|---|---|
| ఇతర పేర్లు | |
| గుర్తింపు విషయాలు | |
| సి.ఎ.ఎస్. సంఖ్య | [10361-37-2] |
| పబ్ కెమ్ | 25204 |
| యూరోపియన్ కమిషన్ సంఖ్య | 233-788-1 |
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | CQ8750000 (anhydrous) CQ8751000 (dihydrate) |
| SMILES | [Ba+2].[Cl-].[Cl-] |
| |
| ధర్మములు | |
| BaCl2 | |
| మోలార్ ద్రవ్యరాశి | 208.23 g/mol (anhydrous) 244.26 g/mol (dihydrate) |
| స్వరూపం | White solid |
| సాంద్రత | 3.856 g/cm3 (anhydrous) 3.0979 g/cm3 (dihydrate) |
| ద్రవీభవన స్థానం | 962 °C (1,764 °F; 1,235 K) (960 °C, dihydrate) |
| బాష్పీభవన స్థానం | 1,560 °C (2,840 °F; 1,830 K) |
| 31.2 g/100 mL (0 °C) 35.8 g/100 mL (20 °C) 59.4 g/100 mL (100 °C) | |
| ద్రావణీయత | soluble in methanol, insoluble in ethanol, ethyl acetate[2] |
| నిర్మాణం | |
స్ఫటిక నిర్మాణం
|
orthogonal (anhydrous) monoclinic (dihydrate) |
కోఆర్డినేషన్ జ్యామితి
|
7-9 |
| ఉష్ణగతిక రసాయన శాస్త్రము | |
| నిర్మాణము మారుటకు కావాల్సిన ప్రామాణిక ఎంథ్రఫీ ΔfH |
−858.56 kJ/mol |
| ప్రమాదాలు | |
| ఇ.యు.వర్గీకరణ | {{{value}}} |
| R-పదబంధాలు | R20, R25 |
| S-పదబంధాలు | (S1/2), S45 |
| జ్వలన స్థానం | {{{value}}} |
| US health exposure limits (NIOSH): | |
PEL (Permissible)
|
TWA 0.5 mg/m3[3] |
REL (Recommended)
|
TWA 0.5 mg/m3[3] |
IDLH (Immediate danger)
|
50 mg/m3[3] |
| సంబంధిత సమ్మేళనాలు | |
| ఇతరఅయాన్లు | {{{value}}} |
ఇతర కాటయాన్లు
|
Beryllium chloride Magnesium chloride Calcium chloride Strontium chloride Radium chloride Lead chloride |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |
భౌతిక లక్షణాలు
మార్చుఇది ఒక అకర్బన రసాయన సమ్మేళన పదార్థం.బేరియం, క్లోరిన్ మూలకాల సమ్మేళనం వలన ఈ అకర్బన సమ్మేళనం ఏర్పడినది.ఈసమ్మేళనము యొక్క రసాయనిక ఫార్ములా BaCl2. నీటిలో త్వరగా కరుగు , బేరియం యొక్క సమ్మేళనాలలో బేరియం క్లోరైడ్ ఒకటి. మిగతా బేరియం సమ్మేళనాల వలె,బేరియం క్లోరైడ్ కుడా విష లక్షణాలు కలిగిన సమ్మేళన పదార్థం.తేమను పీల్చుకొనే స్వభావ మున్న పదార్థం ఇది.జ్వాలగా మండించి న పసుపు-ఆకుపచ్చ రంగు మంటను వెలువ రిస్తుంది.
ఇది తెల్లని ఘన పదార్థము.నిర్జల(anhydrous)బేరియం క్లోరైడ్ సాంద్రత 3.856 గ్రాములు/సెం.మీ3. రెండు జలబిందు వులున్న (dihydrate)బేరియం క్లోరైడ్ సాంద్రత 3.0979 గ్రాములు/సెం.మీ3.ద్రవీభవన స్థానం 1560౦C . నీటిలో బేరియం క్లోరైడ్ యొక్క ద్రావణియత,నీటి ఉష్ణోగ్రత పెరిగే కొలది పెరుగుతుంది. 0 °C వద్ద నీటిలో 31.2 గ్రాములు/100 మి.లీ.లలో కరుగగా , అదే 20 °C వద్ద 35.8 గ్రాములు/100 మి.లీ.లలోకరుగును.అలాగే నీటి ఉష్ణోగ్రత 100 °C ఉన్నప్పుడు 59.4 గ్రాములు/100 మి.లీ.లలోకరుగును.
సౌష్టవ లక్షణాలు
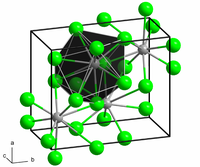
మార్చుబేరియం క్లోరైడ్ బహురూపత(polymorphs)కలిగిన సమ్మేళనం.ఇది రెండు రకాల స్పటిక సౌష్టవం కలిగి ఉన్నది. ఒకటి క్యూబిక్ ఫ్లోరైట్(CaF2) వంటి కలిగి ఉండగా,మరొకటి అర్థో రోంబిక్ కొటున్నిటే (orthorhombiccotunnite (PbCl2)) అణుసౌష్టవం కలిగి ఉన్నది.ఫ్లోరైట్ నిర్మాణం లో Ba2+ యొక్క కోఅర్దినేసన్ 8 కాగా,కొటున్నిటే సౌష్టవఅణు నిర్మాణంలో Ba2+ యొక్క కోఅర్దినేసన్ సంఖ్య 9.
సజల ద్రవంగా బేరియం క్లోరైడ్ సాధారణ లవణం లా ప్రవర్తిస్తుంది. నీటిలో ఇది 1:2 నిష్పత్తిలో తటస్థ pH కలిగి ఉండును. బేరియం క్లోరైడ్ యొక్క సజల ద్రావణాలు సల్ఫేట్ ఆయానులతో ప్రతి చర్య జరపడంవలన తెల్లని అవక్షేప బేరియం సల్ఫేట్ ను ఏర్పరచును.
- Ba2+(aq) + SO42−(aq) → BaSO4(s)
ఆక్సలేట్ తో కుడా బేరియం క్లోరైడ్ ఇటువంటి రసాయనిక చర్య జరుపును.
- Ba2+(aq) + C2O42−(aq) → BaC2O4(s)
బేరియం క్లోరైడు ను సోడియం హైడ్రోక్సైడ్ తో మిశ్రమం/మిళితం చేసిన డై హైడ్రోక్సైడ్ను ఏర్పరచును.ఇది ఒక మోస్తరుగా నీటిలో కరుగును.
ఉత్పత్తి/తయారు చేయుట
మార్చుబేరియం క్లోరైడ్ ను బేరియం హైడ్రోక్సైడ్ లేదా బేరియం కార్బోనేట్ సమ్మేళన పదార్థంతో తయారు చేయుదురు.బేరియం కార్బోనేట్ అను సమ్మేళనం ప్రకృతిలో సహాజంగా వితేరైట్ (witherite)అను ఖనిజ రూపంలో లభ్య మవుతుంది.ఈ క్షారలవణాలు హైడ్రోక్లోరిక్ ఆమ్లంతో రసాయనిక చర్య జరపడం వలన hydrated బేరియం క్లోరైడ్ ఏర్పడును. వ్యాపార స్థాయిలో అయినచో రెండు దశలలో బారైట్(barium sulfate)నుండి తయారు చెయ్యుదురు.
- BaSO4(s) + 4 C(s) → BaS(s) + 4 CO(g)
మొదటి దశలో చర్య జరుగుటకు అధిక ఉష్ణోగ్రత కావలయును.
- BaS + CaCl2 → BaCl2 + CaS
రెండవ దశలో ఏర్పడిన చర్యాజనితాలు సంలీనము (fusion)చెందేలా చేయుదురు.ఏర్పడిన ఫలితాంశాలకు నీటిని కలిపి బేరియం క్లోరైడును సంగ్రహించెదరు.దీనిని సాంద్రికరించిన రెండు బిందువుల నీటినికలిగిన బేరియం క్లోరైడ్( BaCl2•2H2O) స్పటికాలు ఏర్పడును.
ఉపయోగాలు
మార్చునీటిలో కరిగే బేరియం లవణ సమ్మేళనాలలో చవుకైనది బేరియం క్లోరైడ్.దీనిని ప్రయోగశాలలో విరివిగా ఉపయోగిస్తారు.ముఖ్యంగా సల్ఫేట్ అయాను ద్రువికరణ పరీక్షలలో వాడెదరు.కాస్టిక్ క్లోరిన్ యూనిట్ లలో లవణద్రావణం(brine)ను శుద్ధిచెయ్యుటకైఉపయోగిస్తారు.అలాగే వర్ణకారకాలు(pigments)తయారు ఫ్యాక్టరిలలోను ఉపయోగిస్తారు.అలాగే బాణసంచు/మందుగుండు(దీపావళి)సామాను తయారీలో ప్రకాశవంతమైన ఆకుపచ్చ రంగు వెలుతురు ఇచ్చుటకై వాడెదరు.అల్లాగే ఉక్కును కారిన పరిచే కేస్ హర్డే నింగ్ (case hardening)ప్రక్రియలోనూ ఉపయోగిస్తారు.
భద్రత
మార్చునీటిలోకరిగేమిగతా బేరియం సమ్మేళనలవణాలవాలే బెరియంక్లోరైడ్ కుడా విషప్రభావం కలిగిన సమ్మేళనం.
మూలాలు
మార్చు- ↑ https://play.google.com/books/reader?printsec=frontcover&output=reader&id=nKQ-AAAAYAAJ&pg=GBS.PA64
- ↑ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- ↑ 3.0 3.1 3.2 NIOSH Pocket Guide to Chemical Hazards. "#0045". National Institute for Occupational Safety and Health (NIOSH).