కాల్షియం హైపోక్లోరైట్
కాల్సియం హైపోక్లోరైట్ఒక రసాయన సమ్మేళన పదార్థం.ఇది ఒక అకర్బన రసాయన సమ్మేళన పదార్థం.కాల్సియం, క్లోరిన్, ఆక్సిజన్ మూలకాల పరమాణువుల సంయోగం వలన కాల్సియం హైపోక్లోరైట్ రసాయన సమ్మేళనపదార్థం ఏర్పడినది. కాల్సియం హైపోక్లోరైట్ రసాయన సమ్మేళన పదార్థం యొక్క రసాయన సంకేతపదం Ca (ClO) 2. సున్నం, కాల్సియం క్లోరైడ్ లమిశ్ర మైన ఈ రసాయన సంయోగ పదార్థాన్ని విపణి వీధిలో క్లోరిన్ పొడి లేదా విరంజన చూర్ణం (bleaching powder) అను పేరున అమ్మబడుచున్నది. దీనిని నీటిని శుద్ధికరణప్లాంటు లలో బ్లీచింగ్ కారకంగా ఉపయోగిస్తారు. సోడియం హైపోక్లోరైట్ కన్న కాల్సియం హైపోక్లోరైట్ ఎక్కువ స్థిరమైనది, ఎక్కువ ప్రమాణంలో క్లోరిన్ ను కలిగి ఉంది.
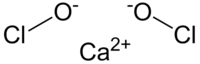
| |
| పేర్లు | |
|---|---|
| ఇతర పేర్లు
Hypochlorous acid, calcium salt
Bleaching powder, Calcium oxychloride | |
| గుర్తింపు విషయాలు | |
| సి.ఎ.ఎస్. సంఖ్య | [7778-54-3] |
| పబ్ కెమ్ | 24504 |
| యూరోపియన్ కమిషన్ సంఖ్య | 231-908-7 |
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | NH3485000 |
| SMILES | [Ca+2].[O-]Cl.[O-]Cl |
| |
| ధర్మములు | |
| Ca(ClO)2 | |
| మోలార్ ద్రవ్యరాశి | 142.98 g/mol |
| స్వరూపం | white/gray powder |
| సాంద్రత | 2.35 g/cm3 (20 °C) |
| ద్రవీభవన స్థానం | 100 °C (212 °F; 373 K) |
| బాష్పీభవన స్థానం | 175 °C (347 °F; 448 K) decomposes |
| 21 g/100 mL, reacts | |
| ద్రావణీయత | reacts in alcohol |
| ప్రమాదాలు | |
| భద్రత సమాచార పత్రము | ICSC 0638 |
| ఇ.యు.వర్గీకరణ | {{{value}}} |
| R-పదబంధాలు | R8, R22, మూస:R31, R34, R50 |
| S-పదబంధాలు | (S1/2), S26, S36/37/39, S45, S61 |
| జ్వలన స్థానం | {{{value}}} |
| Lethal dose or concentration (LD, LC): | |
LD50 (median dose)
|
850 mg/kg (oral, rat) |
| సంబంధిత సమ్మేళనాలు | |
| ఇతరఅయాన్లు | {{{value}}} |
ఇతర కాటయాన్లు
|
Sodium hypochlorite |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |
కాల్సియం హైపోక్లోరైట్ ఇతర పేర్లు
మార్చుకాల్సియం హైపోక్లోరైట్ ను ఇంకా హైపోక్లోరస్ ఆమ్లం, కాల్సియం లవణం, బ్లీచింగ్ పౌడర్/విరంజన చూర్ణం, కాల్సియం అక్సిక్లోరైడ్ అనికూడా పిలుస్తారు.
భౌతిక లక్షణాలు/ధర్మాలు
మార్చుసోడియం హైపోక్లోరైట్ తెల్లని ఘన పదార్థం.వ్యాపారస్థాయిలో ఉత్పత్తి చేసిన సోడియం హైపోక్లోరైట్ పసుపు రంగులో ఉండును.తేమ గలిగిన గాలిలో సోడియం హైపోక్లోరైట్ నెమ్మదిగా వియోగం చెందటం వలన ఘాటైన క్లోరిన్ వాసన కల్గి ఉన్నది.[1] నీటిలో ద్రావణీయత మధ్యస్తంగా ఉండును.సాధు/మృదు జలంతో, మద్యస్థంగా కరినత కలిగిన నీటిలో దీనిని ఉపయోగిస్తారు. ఇదిపొడి (Dry), తడి (hydrated) రూపాలలో లభించును.
సోడియం హైపోక్లోరైట్ అణుభారం 142.98 గ్రాములు/మోల్[2].సాధారణ ఉష్ణోగ్రత (20 °C) వద్ద సోడియం హైపోక్లోరైట్ సాంద్రత 2.35 గ్రాములు/సెం.మీ3[1].సోడియం హైపోక్లోరైట్ ద్రవీభవన స్థానం 100 °C (212 °F; 373K). సోడియం హైపోక్లోరైట్ బాష్పీభవన స్థానం 175 °C (347 °F; 448K), ఈ ఉష్ణోగ్రత వద్ద ఈ రసాయన పదార్థం విఘటన చెందును.
ద్రావణీయత
మార్చుసోడియం హైపోక్లోరైట్ నీటిలో కరుగుతుంది. 100 మి.లీ.నీటిలో 21 గ్రాముల వరకు సోడియం హైపోక్లోరైట్ కరుగుతుంది. నీటితోచర్యజరుపును. అలాగే ఆల్కహాల్తో చర్యజరుపును.
ఉత్పత్తి
మార్చుసోడియం హైపోక్లోరైట్ ను కాల్సియం హైడ్రాక్సైడ్/తడి సున్నంతో క్లోరిన్ వాయువు రసాయనచర్య వలన ఉత్పత్తి చేయుదురు.ఈ రసాయన చర్యలను దశలవారిగా/అంచెలంచెలుగావివిధ గాఢతలతో, వివిధ మేళనము (compositions) తో చేయుదురు.పూర్తి పరివర్తన ఈ దిగువ విధంగా ఉండును.
- 2 Cl2 + 2 Ca(OH)2 → Ca(OCl)2 + CaCl2 + 2 H2O
బ్లీచింగ్ పౌడర్ను కొద్దిగా తడిగా ఉన్న సున్నంతో తయారు చేయుదురు.బ్లీచింగ్ పౌడర్ కేవలం కాల్సియం హైపోక్లోరైట్, కాల్సియం క్లోరైడ్, కాల్సియం హైడ్రాక్సైడ్ల మిశ్రమం మాత్రమే కాదు, ఈ మిశ్రమం ప్రధనంగా కాల్సియం హైపోక్లోరైట్ (Ca (OCl) 2), డైబేసిక్ కాల్సియం హైపోక్లోరైట్ (Ca3 (OCl) 2 (OH) 4), డైబేసిక్ కాల్సియం క్లోరైడ్ (Ca3Cl2 (OH) 4) లను కలిగి ఉంది.
రసాయన చర్యలు
మార్చుసోడియం హైపోక్లోరైట్ కార్బన్ డయాక్సైడ్తో చర్యవలన కాల్సియం కార్బోనేట్ ఏర్పడి డైక్లోరిన్ మొనాక్సైడ్ విడుదల అగును.
- Ca(ClO)2 + CO2 → CaCO3 + Cl2O↑
కాల్సియం హైపోక్లోరైట్ ద్రవం ఒక క్షార ద్రావణం.కాల్సియం హైపోక్లోరైట్ అయాన్ జలవిశ్లేషణ కారణంగా ఏర్పడిన హైపోక్లోరస్ ఆమ్లం బలహీనమైన ఆమ్లం. కాని కాల్సియం హైడ్రాక్సైడ్ బలమైన క్షారము.అందుచేత కాల్సియం హైపోక్లోరైట్ అయాన్ బలమైన సందిగ్ద క్షారము, కాల్సియం అయాన్ (ion) బలహీనమైన సందిగ్ద ఆమ్లం (conjugate acid).
- ClO− + H2O → HClO + OH−
అదేవిధంగా హైడ్రోక్లోరిక్ ఆమ్లంతో కాల్సియం హైపోక్లోరైట్ రసాయనచర్య వలన కాల్సియం క్లోరైడ్, నీరు, క్లోరిన్ ఏర్పడును.
- Ca(OCl)2 + 4 HCl → CaCl2 + 2 H2O + 2 Cl2
ఉపయోగాలు
మార్చుపారిశుధ్యం
మార్చుసాధారణంగా సోడియం హైపోక్లోరైట్ను పబ్లిక్ ఈతకొలనులను పారిశుధ్యం చేయుటకు,, త్రాగు నీటిలోని ప్రమాదకర సూక్ష్మజీవుల క్రిమిసంహారం (disinfect) చేయుటకు ఉపయోగిస్తారు.[3]
సేంద్రియ రసాయన శాస్త్ర పరిధిలో వాడుక
మార్చుసోడియం హైపోక్లోరైట్ సాధారణ ఆక్సీకరణ కారకం.అందువలన దీనిని సేంద్రియ రసాయన శాస్త్ర పరిధిలో ఉపయోగిస్తారు. ఉదాహారణకు గ్లైకోల్స్, α- హైడ్రాక్సీకార్బోక్సిలిక్ ఆమ్లాలను,, కేటోఆమ్లాలను విడగొట్టి ఖండిత అల్దిహైడులను, కార్బోక్సిలిక్ ఆమ్లాలను తయారు చేయుదురు. అలాగే సోడియం హైపోక్లోరైట్ ను హలోఫార్మ్రసాయన ప్రక్రియ (haloform reaction) లో క్లోరోఫారాన్ని ఉత్పత్తికావించుటలో ఉపయోగిస్తారు.
భద్రత
మార్చుపొడిగా ఉన్న చల్లని స్థితిలో, సేంద్రియ రసాయనపదార్థాలకు దూరంగా కాల్సియం హైపోక్లోరైట్ భద్ర పరచెదరు.నిర్జల స్థితిలోకంటే జలయోజిత/ఆర్ద్ర స్థితిలోసురక్షితగా ఉపయోగించవచ్చును.
ఇవికూడా చూడండి
మార్చుమూలాలు/ఆధారాలు
మార్చు- ↑ 1.0 1.1 "CALCIUM HYPOCHLORITE". chemicalland21.com. Retrieved 2016-03-21.
- ↑ "CALCIUM HYPOCHLORITE". pubchem.ncbi.nlm.nih.gov. Retrieved 2016-03-21.
- ↑ "Calcium Hypochlorite" (PDF). who.int. Retrieved 2016-03-21.