క్రోమైల్ ఫ్లోరైడ్
క్రోమైల్ ఫ్లోరైడ్ అనునది ఒక రసాయన సంయోగ పదార్థం.క్రోమైల్ ఫ్లోరైడ్ ఒక ఆకర్బన రసాయన సమ్మేళన పదార్థం.క్రోమియం, ఆక్సిజన్,, ఫ్లోరిన్ మూలకాల పరమాణు సమ్మేళనం వలన క్రోమైల్ ఫ్లోరైడ్ సంయోగ పదార్థం ఏర్పడినది.ఈ రసాయన సంయోగ పదార్థం యొక్క రసాయన సంకేత పదం CrO2F2[2].ఇది వైలెట్ ఎరుపురంగు స్పటికపదార్థం, ద్రవీకరించినపుడు ఆరెంజి-ఎరుపు రంగును సంతరించు కొనును[3].
| |
| పేర్లు | |
|---|---|
| IUPAC నామము
Difluoro(dioxo)chromium
| |
| ఇతర పేర్లు
Chromyl Fluoride, Chromium Difluoride Dioxide
| |
| గుర్తింపు విషయాలు | |
| సి.ఎ.ఎస్. సంఖ్య | [7788-96-7] |
| యూరోపియన్ కమిషన్ సంఖ్య | 232-137-9 |
| SMILES | O=[Cr](=O)(F)F |
| |
| ధర్మములు | |
| CrO2F2 | |
| మోలార్ ద్రవ్యరాశి | 112 g/mol |
| స్వరూపం | violet crystals |
| ద్రవీభవన స్థానం | 31.6 °C (88.9 °F; 304.8 K) |
| బాష్పీభవన స్థానం | 30 °C (86 °F; 303 K)[1] Sublimes |
| ప్రమాదాలు | |
| ప్రధానమైన ప్రమాదాలు | Oxidant |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |
భౌతిక ధర్మాలు
మార్చుభౌతిక స్థితి
మార్చుక్రోమైల్ ఫ్లోరైడ్ వైలెట్ స్పటికరూపంలో ఘనస్థితిలో ఉండును. క్రోమైల్ ఫ్లోరైడ్ అణుభారం121.99 గ్రాములు/మోల్[2].
ద్రవీభవన ఉష్ణోగ్రత
మార్చుక్రోమైల్ ఫ్లోరైడ్ ద్రవీభవన స్థానం 31.6 °C (88.9 °F; 304.8K)
అణుసౌష్టవం
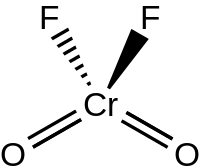
మార్చుక్రోమైల్ ఫ్లోరైడ్ ద్రవ, వాయుస్థితిలో చర్భుజ భూజ్యామితితో C2V సౌష్టవంతో, క్రోమెయిల్ క్లోరైడ్ అణునిర్మాణ పోలిక కల్గివుండును.క్రోమైల్ ఫ్లోరైడ్ Z=4 విలువతో, P21/c స్పేస్ సమూహంగా స్పటికరణ చెందును. అణువులో క్రోమియం=ఆక్సిజన్ (Cr=O) బంధ దూరం 157 pm,, క్రోమియం –ఫ్లోరిన్ బంధ దూరాలు 181.7, 186.7,,209.4pm.అణువులో క్రోమియం పరమాణు.కోఅర్డినేసన్ సంఖ్య6కల్గి, చెదరిన/వక్రీకృత అష్టభుజాకృత స్థితిలో ఉండును[4][5].
చరిత్ర-ఉత్పత్తి
మార్చుక్రోమైల్ ఫ్లోరైడ్ను మొదటగా 1952లో ఏంజెల్ బ్రేక్ట్, గ్రోసే (Engelbrecht and Grosse) వేరుచేశారు.19 వ శతాబ్ది ప్రారంభంలో ఫ్లోరొస్ప్లర్ (CaF2) క్రోమేట్ మిశ్రమాలను, సల్ఫ్యూరిక్ ఆమ్లంతో వేడి చేసినపుడు ఎర్రని ఆవిరిలు వెలువడటం గమనించారు. మొదట్లో ఈ వాయువులను/ఆవిరులను క్రోమియంహెక్సా ఫ్లోరైడ్ (CrF6) గా భావించారు.అయినప్పటికీ కొందరు రసాయన శాస్త్ర వేత్తలు, రసాయన పదార్థవిశ్లేషకులు క్రోమెయిల్ క్లోరైడ్ (CrO2Cl2) ను పోలిన క్రోమైల్ ఫ్లోరైడ్ అణునిర్మాణాన్ని ఉహించారు.మొదట ఫ్రేడేన్హగెన్ హైడ్రోజన్ ఫ్లోరైడ్లను క్షార క్రోమేట్లతో రసాయన చరుఅలను పరీక్షించిన సందర్భంలో క్రోమైల్ ఫ్లోరైడ్ ను సంశ్లేషణ చేసాడు.తరువాత ప్రయత్నంలో వార్టన్ బెర్గ్ (Wartenberg) CrO2Cl2ను మూలక ఫ్లోరిన్తో చర్య నొందింఛి శుద్ధతలేని/అశుద్ధ క్రోమైల్ ఫ్లోరైడ్ను సంశ్లేషణ చేసాడు.విచెర్ట్ (Wiechert) అనునతడు హైడ్రోజన్ ఫ్లోరైడ్ (HF) ను డైక్రోమేట్తోచర్య జరిపించడం వలన, -40 °Cఉష్ణోగ్రతలో అశుద్ధ క్రోమైల్ ఫ్లోరైడ్ను సంశ్లేషణ చేసాడు.
ఏంజెల్ బ్రేక్ట్, గ్రోసేలు క్రోమియం ట్రైఆక్సైడ్ (CrO3) ను ఫ్లోరినేటింగు ఏజెంట్తో చర్య జరిపించి, విజయవంతంగా క్రోమైల్ ఫ్లోరైడ్ ను సంశ్లేషణ చేసారు[4]
- CrO3 + 2 HF → CrO2F2 + H2O
ఈ రసాయన చర్య తిరోగామి రసాయన చర్య. నీటితో చర్య వలన, జలవిశ్లేషణకారణంగా క్రోమైల్ ఫ్లోరైడ్ తిరిగి క్రోమియం ట్రైఆక్సైడ్ (CrO3) గా మారును. క్రోమియం ట్రైఆక్సైడ్ను ఇతర పద్ధతులలో క్లోరిన్ ఫ్లోరైడ్, కార్బోనైల్ ఫ్లోరైడ్, లేదా కొన్ని లోహ హెక్సాఫ్లోరైడ్స్లతో చర్య వలన కూడా క్రోమైల్ ఫ్లోరైడ్ను ఉత్పతి చేయవచ్చును[4].
- CrO3 + 2 ClF → CrO2F2 + Cl2 + O2
- CrO3 + COF2 → CrO2F2 + CO2
- CrO3 + MF6 → CrO2F2 + MOF4 (M = Mo, W)
పైన వివరించిన రసాయన చర్యలలో చివరి విధానంలో, టంగ్స్టన్, మాల్బిడినియం ఫ్లోరైడులను ఉపయోగించిగ్రీన్, గార్డ్ లు సాధారణమైన, ప్రభావశిలమైన విధానంలో అధిక ప్రమాణంలో శుద్ధమైన క్రోమైల్ ఫ్లోరైడ్ ను ఉత్పత్తిచేసారు.వారు చెప్పిన ప్రకారం ఈ ప్రక్రియను 120 °Cవద్ద జరపడం వలన 100%శుద్ధమైన క్రోమైల్ ఫ్లోరైడ్ ను ఉత్పత్తి చేయవచ్చును.
రసాయన చర్యలు
మార్చుక్రోమైల్ ఫ్లోరైడ్ ను ఉపయోగించి హైడ్రోకార్బనులను కిటోనులుగా, కార్బాక్సిలిక్ ఆమ్లాలుగా మార్చడంతోపాటు, పలు రసాయన చర్యాల్లో క్రోమైల్ ఫ్లోరైడ్ ను ఉపయోగించవచ్చునని బ్రౌన్, గ్రీన్,, గార్డ్ లు తమ రచనలో తెలిపారు.క్రోమైల్ ఫ్లోరైడ్ లోహ ఆక్సైడ్ లతో ఫ్లోరిన్ పరమాణులను మార్పిడి (exchange) చేసుకోనును[6].
- CrO2F2 + MO → MF2 + CrO3
క్రోమైల్ ఫ్లోరైడ్ సంయోగ పదార్థం, బోరాన్, సిలికాన్ ఆక్సైడ్ లను ఫ్లోరైడ్ లుగా మార్చును.క్రోమైల్ ఫ్లోరైడ్ సంయోగ పదార్థం పేర్ఫ్లోహెప్టేన్ ద్రావణిలో క్షారాల, క్షారమృత్తికలోహల ఫ్లోరైడ్లతో రసాయన చర్య వలన ఆరెంజి రంగు ఉన్న ఫ్లోరో క్రోమేట్ లను ఉత్పత్తి కావించును
- CrO2F2 + 2 MF → M2CrO2F4
అలాగే లేవిస్ ఆమ్లాలతో (Lewis acids) రసాయన చర్యలో పాల్గోనును. CrO2F2 + 2 (CF3CO) 2O → CrO2 (CF3COO) 2 + 2CF3COF బలహీన క్షారాలు నైట్రోజన్ మొనాక్సైడ్, నైట్రోజన్ డయాక్సైడ్, సల్ఫర్ డయాక్సైడ్ లతో అదనపు రసాయన చర్యలు (adducts) చేయును.
వినియోగం
మార్చుక్రోమైల్ ఫ్లోరైడ్ బలమైన ఆక్సికరణి, హైడ్రోకార్బన్ లను కిటోనులుగా, కార్బోక్సిలిక్ ఆమ్లాలుగా మార్చు నంతటి బలమైన ఆక్సీకరణి.మిగిలిన క్రోమైల్ సంయోగ పదార్థాల తయారీలో క్రోమైల్ ఫ్లోరైడ్ ను రసాయన కారకంగా ఉపయోగిస్తారు[3].మిగిలిన ఫ్లోరైడ్ సంయోగ పదార్థాలవలె గాజు, క్వార్జ్ తో రసాయన చర్య జరుపును.అందువలన ఈ రసాయాన పదార్థాన్ని ఉపయోగించునపుడు సిలికాన్ రహిత ప్లాస్టిక్, లోహ పరికరాలను వాడవలెను.
మూలాలు/ఆధారాలు
మార్చు- ↑ Brauer, Georg (1963) [1960]. Handbuch Der Präparativen Anorganischen Chemie [Handbook of Preparative Inorganic Chemistry] (in German). Vol. 1. Stuttgart; New York, New York: Ferdinand Enke Verlag; Academic Press, Inc. p. 259. ISBN 978-0-32316127-5. Retrieved 2014-01-12.
{{cite book}}: CS1 maint: unrecognized language (link) - ↑ 2.0 2.1 "Chromyl fluoride". webbook.nist.gov. Retrieved 2016-04-09.
- ↑ 3.0 3.1 Gard, G. L. "Chromium Difluoride Dioxide (Chromyl Fluoride)" Inorganic Syntheses 1986, Volume 24, p67.
- ↑ 4.0 4.1 4.2 "Chromyl fluoride". america.pink. Retrieved 2016-04-09.
- ↑ Supel, J., Abram, U., Hagenbach, A., Seppelt, K., Technetium Fluoride Trioxide, TcO3F, Preparation and Properties Inorg. Chem., 2007, 46 (14), 5591–5595. doi:10.1021/ic070333y
- ↑ Brown, S. D., Green, P.J., Gard, G.L., The Chemistry of Chromyl Fluoride, III: Reactions with Inorganic Systems. J. Fluorine Chem. 5, 203 doi:10.1016/S0022-1139(00)82482-3
[[వర్గం:క్రోమియం సమ్మేళనాలు]]