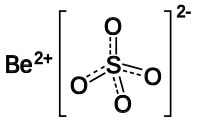
బెరీలియం సల్ఫేట్
బెరీలియం సల్ఫేట్ ఒక అకర్బన రసాయన సంయోగపదార్ధం. ఈ సంయోగపదార్ధం సాధారణంగా నాలుగునీటిఆణువులను కలిగినఆర్ద్ర (tetra-hydrate) బెరీలియం సల్ఫేట్ (BeSO4•4H2O) రూపంలో అధికంగా లభిస్తుంది. బెరీలియం సల్ఫేట్ రసాయన సంకేతపదం BeSO4.
| |

| |
| గుర్తింపు విషయాలు | |
|---|---|
| సి.ఎ.ఎస్. సంఖ్య | [13510-49-1] |
| పబ్ కెమ్ | 26077 |
| యూరోపియన్ కమిషన్ సంఖ్య | 236-842-2 |
| సి.హెచ్.ఇ.బి.ఐ | CHEBI:53473 |
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | DS4800000 |
| SMILES | [Be+2].[O-]S([O-])(=O)=O |
| |
| ధర్మములు | |
| BeSO4 | |
| మోలార్ ద్రవ్యరాశి | 105.075 g/mol (anhydrous) 177.136 g/mol (tetrahydrate) |
| స్వరూపం | white solid |
| వాసన | odorless |
| సాంద్రత | 2.44 g/cm3 (anhydrous) 1.71 g/cm3 (tetrahydrate) |
| ద్రవీభవన స్థానం | 110 °C (230 °F; 383 K) (tetrahydrate, −2H2O) 400 °C (dihydrate, dehydr.) 550–600 decomposes |
| బాష్పీభవన స్థానం | 2,500 °C (4,530 °F; 2,770 K) (anhydrate) 580 °C (tetrahydrate) |
| 36.2 g/100 mL (0 °C) 40.0 g/100 mL (20 °C) 54.3 g/100 mL (60 °C) | |
| ద్రావణీయత | insoluble in alcohol |
| వక్రీభవన గుణకం (nD) | 1.4374 (tetrahydrate) |
| ఉష్ణగతిక రసాయన శాస్త్రము | |
| నిర్మాణము మారుటకు కావాల్సిన ప్రామాణిక ఎంథ్రఫీ ΔfH |
-1197 kJ/mol |
| ప్రామాణిక మోలార్ ఇంథ్రఫీ S |
90 J/mol K |
| ప్రమాదాలు | |
| భద్రత సమాచార పత్రము | ICSC 1351 |
| జి.హెచ్.ఎస్.పటచిత్రాలు |   
|
| జి.హెచ్.ఎస్.సంకేత పదం | DANGER |
| జి.హెచ్.ఎస్.ప్రమాద ప్రకటనలు | H350, H330, H301, H372, H319, H335, H315, H317, H411 |
| ఇ.యు.వర్గీకరణ | {{{value}}} |
| R-పదబంధాలు | మూస:R49, R25, R26, R36/37/38, మూస:R43, మూస:R48/23, మూస:R51/53 |
| S-పదబంధాలు | S53, S45 |
| జ్వలన స్థానం | {{{value}}} |
| Lethal dose or concentration (LD, LC): | |
LD50 (median dose)
|
82 mg/kg (rat, oral) 80 mg/kg (mouse, oral) |
| US health exposure limits (NIOSH): | |
PEL (Permissible)
|
TWA 0.002 mg/m3 C 0.005 mg/m3 (30 minutes), with a maximum peak of 0.025 mg/m3 (as Be) |
REL (Recommended)
|
Ca C 0.0005 mg/m3 (as Be) |
IDLH (Immediate danger)
|
Ca [4 mg/m3 (as Be)] |
| సంబంధిత సమ్మేళనాలు | |
ఇతర కాటయాన్లు
|
Magnesium sulfate Calcium sulfate Strontium sulfate Barium sulfate |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |
ఆవిష్కరణ
మార్చుబెరీలియం సల్ఫేట్ను జోన్స్ జాకోబ్ బెంజిలియస్ (Jons Jakob Berzelius)1815లో మొదటి సారిగా కనుగొన్నాడు[2].
భౌతికధర్మాలు
మార్చుబెరీలియం సల్ఫేట్ భౌతికంగా తెల్లని పొడిరూపంలో ఉండును. నిర్జల/అనార్ద్ర బెరీలియం సల్ఫేట్ అణుభారం 105.075 గ్రాములు/మోల్. నాలుగు జలఅణువులు కలిగిన టెట్రాహైడ్రేట్ బెరీలియం సల్ఫేట్ అణుభారం 177.136 గ్రాములు/మోల్.నిర్జల/అనార్ద్ర బెరీలియం సల్ఫేట్ సాంద్రత2.44 గ్రాములు/సెం.మీ3. నాలుగు జలఅణువులుకలిగిన టెట్రాహైడ్రేట్ బెరీలియం సల్ఫేట్ సాంద్రత 1.71గ్రాములు/సెం.మీ3. టెట్రాహైడ్రేట్ బెరీలియం సల్ఫేట్ బాష్పీభవన స్థానం 580 °C. నిర్జల/అనార్ద్ర బెరీలియం సల్ఫేట్ బాష్పీభవన స్థానం 2,500 °C (4,530 °F; 2,770K). టెట్రాహైడ్రేట్ బెరీలియం సల్ఫేట్ ను 110 °C ఉష్ణోగ్రత వరకు వేడిచేసిన రెండు నీటిఅణువు లను కోల్పోవును. 400 °C వద్ద మిగతా రెండు నీటి అణువులను కోల్పోవును.550–600 °Cవద్ద విఘటన చెందును.బెరీలియం సల్ఫేట్ నీటిలో కరుగుతుంది.ఆల్కహాలులో కరుగదు.టెట్రా హైడ్రేట్ బెరీలియం సల్ఫేట్ వక్రీభవన సూచిక1.4374
ఉత్పత్తి
మార్చుఏదైనసజల బెరిలీయం లవణాన్ని సల్ఫ్యూరిక్ ఆమ్లంతో చర్యనొందించి, ఏర్పడిన ద్రవాన్ని ఇగిర్చి (evaporation, స్పటికికరించం వలన బెరీలియం సల్ఫేటును ఉత్పత్తి చెయ్యుదురు.ఈ విధంగా ఏర్పడిన ఆర్ద్ర బెరీలియం సల్ఫేట్ ను 400 °C ఉష్ణోగ్రత వరకు వేడిచెయ్యడం వలన నిర్జల/అనార్ద్ర బెరీలియం సల్ఫేట్ ఏర్పడును.[3]
అణుసౌష్టవం
మార్చుటెట్రాహైడ్రేట్ బెరీలియం సల్ఫేట్ చతుస్కోణ (tetrahedral) Be (OH2) 42+, సల్ఫేట్ ఆనయాను (anions) లను కలిగి ఉండును. నిర్జల బెరీలియం సల్ఫేట్ సంయోగపదార్థ అణుసౌష్టవం బెరిలినైట్ అణునిర్మాణ పోలిక కలిగిఉండును.అణువులో బెరీలియం-ఆక్సిజన్ పరమాణు కేంద్రాల దూరం 156 pm, సల్ఫర్-ఆక్సిజన్ కేంద్రకాల దూరం 150 pm[4].
ఉపయోగాలు
మార్చుబెరీలియం సల్ఫేట్, రేడియం సల్ఫేట్ మిశ్రమాన్ని కేంద్రక విచ్ఛిత్తి/అణువిచ్ఛేదన (nuclear fission) ను గుర్తించుటకు న్యూట్రాన్ వనరుగా ఉపయోగిస్తారు.
ఇవికూడా చూడండి
మార్చుమూలాలు/అధారాలు
మార్చు- ↑ Weast, Robert C., ed. (1981). CRC Handbook of Chemistry and Physics (62nd ed.). Boca Raton, FL: CRC Press. p. B-82. ISBN 0-8493-0462-8..
- ↑ Lathrop Parsons, Charles (1909), The Chemistry and Literature of Beryllium, London, pp. 29–33
{{citation}}: CS1 maint: location missing publisher (link). - ↑ Patnaik, Pradyot (2002), Handbook of Inorganic Chemicals, McGraw-Hill, ISBN 0-07-049439-8.
- ↑ Grund, Alfred (1955). "Die Kristallstruktur von BeSO4". Tschermaks Mineralogische und Petrographische Mitteilungen. 5 (3): 227–230. doi:10.1007/BF01191066. ISSN 0041-3763.