ఆవర్తన పట్టిక
"ఆవర్తన పట్టిక" అనునది రసాయన మూలకాలను వాటి పరమాణు సంఖ్యలు, ఎలక్ట్రాన్ విన్యాసముల ఆవర్తన రసాయన ధర్మముల ఆధారంగా యేర్పాటు చేయబడిన ఒక అమరిక. ఈ పట్టికలో మూలకాలు వాటి పరమాణు సంఖ్య ఆరోహణ క్రమంలో అమర్చబడినవి. ఈ పట్టికలో ప్రామాణీకరించబడిన ప్రకారం 18 నిలువు వరుసలు, 7 అడ్డు వరుసలు గానూ, పట్టిక క్రింది భాగంలో రెండు ప్రత్యేక వరుసలు అమర్చబడినవి. ఈ పట్టికను నాలుగు బ్లాకులుగా విభజింపవచ్చు. వాటిలో s-బ్లాకు మూలకాలు ఎడమ వైపు, p-బ్లాకు మూలకాలు కుడి వైపున, d-బ్లాకు మూలకాలు పట్టిక మధ్య భాగం లోనూ, f-బ్లాకు మూలకాలు పట్టిక దిగువ భాగంలోనూ అమర్చబడి ఉన్నాయి.
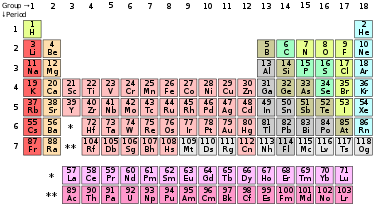
ఆవర్తన పట్టికలో అడ్డు వరుసలను పీరియడ్లు అని, నిలువు వరుసలను గ్రూపులు అని వ్యవహరిస్తారు. ఈ గ్రూపులలో కొన్నింటికి హాలోజనులు లేదా జడ వాయువులు వంటి పేర్లతో పిలుస్తారు. నిర్వచనం ప్రకారం ఆవర్తన ధర్మాలను కలిగియుండినప్పటికీ ఆ పట్టిక మూలకాల ధర్మములను, క్రొత్తగా వచ్చిన, ఇంకా కనుగొనబడని మూలకాల యొక్క ధర్మముల మధ్య సంబంధములను వివరించుటకు కూడా ఉపయోగపడుతుంది. ఈ పట్టిక విస్తృతంగా రసాయన శాస్త్రం, ఇతర శాస్త్రాల్లో ఉపయోగిస్తారు.
పూర్వగాములు ఉన్నప్పటికీ డిమిట్రి మెండలీవ్ 1869 లో మొదటి సారి ఆవర్తన పట్టికను ప్రచురణ చేసిన వ్యక్తిగా గుర్తింబడ్డాడు. అతను అప్పటికి తెలిసిన మూలకాలను వాటి ధర్మాల ఆధారంగా (పరమాణు భారం) వర్గీకరణను అభివృద్ధిపరచాడు. మెండలీఫ్ కూడా కొన్ని కనుగొనబడని మూలకాలను ఊహించి వాటికి కూడా కొన్ని ఖాళీలను పట్టికలో ఉంచి వాటికి స్థానం కల్పించాడు. ఆయన ఊహించిన మూలాకాలలో చాలా మూలకాలను తదుపరి కాలంలో కనుగొని వాటికి సూచించిన ఖాళీలలో అమర్చారు. తర్వాతి కాలంలో మరికొన్ని మూలకాలను కనుగొన్న తదుపరి మెండలీఫ్ ఆవర్తన పట్టికను విస్తృతపరచారు. తర్వాత తయారుచేయబడిన ఆవర్తన పట్టికలో మూలకాల రసాయన ధర్మాల ఆధారంగా సిద్దాంతీకరించారు.
పరమణు సంఖ్య 1 (హైడ్రోజన్ ) నుండి 118 (ఒగనేసన్) వరకు గల అన్ని మూలకాలలో కొన్ని కనుగొనబడినవి మరికొన్ని కృత్రిమంగా తయారుచేయబడినవి. ఆవర్తన పట్టికలో మొదటి 98 మూలకాలు ప్రకృతిలో సహజంగా గలవి. మరికొన్ని మూలకాలు [n 1] వాటిలో కొన్ని మూలకాలు ప్రయోగశాలలో కృత్రిమంగా కనుగొనబడినవి. పరమాణు సంఖ్యలు 99 నుండి 118 వరకు గల మూలకాలను కృత్రిమంగా సృష్టించారు. అధిక పరమాణు సంఖ్య కలిగిన మూలకాలు ఉత్పత్తి ఆవర్తన పట్టికలో కొనసాగుతున్న చర్చనీయాంశంగానే ఉండటం అటువంటి చేర్పులు స్థానం కల్పించే మార్పు అవసరం అనేది ప్రశ్నార్థకంగా మారింది. అనేక కృత్రిమ రేడియోన్యూక్లైడ్ సహజంగా మూలకాలులు కూడా ప్రయోగశాలల్లో ఉత్పత్తి చేయబడ్డాయి.
నమూనా
మార్చు- పూర్తి వివరాలతో కూడిన ఆవర్తన పట్టిక కోసం చూడండి విస్తృత ఆవర్తన పట్టిక
| Group | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hydrogen & alkali metals |
Alkaline earth metals | Pnictogens | Chalcogens | Halogens | Noble gases | ||||||||||||||
| Period |
|||||||||||||||||||
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
| Border shows natural occurrence of the element: | Primordial | From decay | Synthetic |
- Ca: 40.078 — Formal short value, rounded (no uncertainty)[2]
- Po: [209] — mass number of the most stable isotope
ఆవర్తన పట్టిక లోని అన్ని స్థానాలలో మిశ్రమాలు, సంయోగ పదార్థాలు, ఉప పరమాణు కణాలును కాకుండా రసాయన మూలకాలు మాత్రమే ఉంటాయి [n 2] ప్రతి రసాయన మూలకం ఏకైక పరమాణు సంఖ్యను లేదా పరమాణు కేంద్రకంలోని ప్రోటాన్ల సంఖ్యను కలిగి ఉంటుంది. అనేక మూలకాలు న్యూట్రాన్ల సంఖ్యలు వివిధ రకాలుగా కలిగి ఉంటాయి. ఒకే మూలకంలో న్యూట్రాన్ల సఖ్యలో తేడాలు కలిగిఉంటే వాటిని ఐసోటోపులు అంటారు. ఉదాహరణకు కార్బన్ పరమాణువు సహజంగా మూడు ఐసోటోపులు కలిగి ఉంటుంది. అన్ని కార్బన్ పరమాణువులు ఆరు ప్రోటాన్లను కలిగి ఉంటాయి. కానీ ఒక శాతం పరమాణువులలో ఏడు న్యూట్రాన్లను కలిగి ఉంటుంది. ఐసోటోపులు ఆవర్తన పట్టికలో విడదీయలేము. అన్ని ఐసోటోపులు ఒకే ప్రోటాన్ల సంఖ్యను కలిగి ఉండుట వలన ఒకే మూలకంగా గుర్తింపబడుతుంది.[3]
ప్రామాణిక ఆవర్తనపట్టికలో మూలకాలు వాటి పరమాణు సంఖ్యల ఆరోహణ క్రమంలో అమరి ఉంటాయి. ప్రతి అడ్డువరుస (పీరియడ్ ) క్రొత్త కర్పరం (కక్ష్య) లో కొత్త ఎలక్ట్రాన్ చేరుటతో ప్రారంభమైనది. ప్రతి నిలువు వరుస (గ్రూపు లలో మూలకాలు వాటి ఎలక్ట్రాన్ విన్యాసము ఆధారంగా అమర్చబడి ఉంటాయి. బాహ్య కక్ష్యలో ఒకే సంఖ్యలో ఎలక్ట్రాన్లు గల మూలకాలన్నీ ఒకే గ్రూపులో అమరి ఉంటాయి (ఉదా: ఆక్సిజన్, సెలేనియం మూలకాలు వాటి బాహ్యకక్ష్యలో నాలుగు ఎలక్ట్రాన్లు కలిగి ఉంటాయి. అందువల్ల అవి ఒకే గ్రూపులో అమరి ఉన్నాయి). ఒకే రసాయన ధర్మములు కలిగిన మూలకాలన్నీ ఆవర్తనపట్టికలో సాధారణంలో ఒకే గ్రూపులో ఉంటాయి. అదే విధంగా f-బ్లాకు మూలకాలు, d-బ్లాకు మూలకాలు పీరియడ్లలో కూడా ఒకే ధర్మాలను కలిగి ఉంటాయి[4]
2013 నాటికి ఆవర్తన పట్టికలో 114 మూలకాలను కనుగొన్నారు. వీటిలో 1 (హైడ్రోజన్) నుండి 112 (కోరెర్నీసియం), 114 (ఫ్లెరోవియం), 116 (లివెర్మోరియం) ఉన్నాయి. 113,115,117, 118 పరమాణు సంఖ్యలుగా గల మూలకాలు ప్రయోగశాలలో కృత్రికంగా తయారుచేయబడినవి. వాటిని IUPAC అధికారికంగా 2015 లో ధ్రువపరిచింది. అవి వరుసగా నిహోనియం (Nh), మాస్కోవియం (Mc), టెన్నెసిన్ (Ts), ఒగనేసన్ (Og).[5]
ఈ మూలకాలలో 98 మూలకాలు సహజసిద్ధమైనవి. మిగిలిన 16 మూలకాలు అనగా ఐన్స్టీనియం నుండి కోపెర్నీషియం వరకు, ప్లెరోవియం, లివెర్మోరియం, వంటివి ప్రయోగశాలలో కృత్రిమంగా తయారుచేయబడ్డాయి. 98 సహజ మూలకాలలో 84 మూలకాలు ఆదిమ మూలకాలు (ప్రీమోర్డియల్ ఎలిమెంట్స్). మిగిలిన 14 మూలకాలు ఆదిమ మూలకాల యొక్క విఘటనం ద్వారా తయారైనవి [6] ఐన్స్టీనియం (మూలకం 99) కంటే భారీ సంఖ్య మూలకం ఎప్పుడూ దాని స్వచ్ఛమైన రూపంలో సూక్ష్మ పరిమాణంలో ఉన్నట్లు గమనించబడింది.[7]
గ్రూపుల పద్ధతి
మార్చుగ్రూపులు
మార్చుఆవర్తన పట్టికలో "గ్రూపు" లేదా "కుటుంబం" అనునది నిలువుగా ఉన్న వరుస. పీరియడ్లు, బ్లాకులులా కాకుండా గ్రూపులు విశిష్టమైన ఆవర్తన ధర్మాలను కలిగి ఉంటాయి. నవీన క్వాంటం సిద్ధాంతం ప్రకారం గ్రూపులలోని మూలకాలకు వేలన్సీ ఎలక్ట్రాన్ విన్యాసం ఒకేవిధంగా ఉంటుంది.[8] అదే విధంగా ఒకే గ్రూపులో గల మూలకాలు ఒకే రకమైన రసాయన ధర్మాలను కలిగి ఉంటాయి.[9] కానీ d-బ్లాకు, f-బ్లాకు మూలకాలలో పరీశీలించినట్లయితే, వాటి నిలువ వరుస లోని సారూప్యాల కన్నా అడ్డు వరస లోని సారూప్యానికే ఎక్కువ ప్రాధాన్యత నిస్తారు.[10][11][12] అంతర్జాతీయ నామకరణ విధానాల పరంగా, ఎడమ వైపున ఉన్న క్షార లోహాల నుండి పూర్తి కుడి వైపున ఉన్న జడ వాయువు ల వరకు ఉన్న గ్రూపు లను సంఖ్యలలో 1 నుండి 18 గా గుర్తించడం జరిగింది.[13] ఇంతకు మునుపు వీటిని రోమను సంఖ్యలో రాసేవారు. అమెరికాలో రోమను సంఖ్యలకు అదనంగా "A"ను (s-బ్లాకు లేదా p-బ్లాకు) కానీ, "B"ను కానీ (d-బ్లాకు) చేర్చుతారు. అనగా రోమను సంఖ్యలు,ఆధునిక నామకరణ విధానం లోని చివరి అంకెను ప్రతిబింబిస్తుంది. (ఉదా: గ్రూపు 4 మూలకాలును IVB అనీ, గ్రూప్ 14 మూలకాలను IVA గా రాస్తారు.యూరోప్ లోని విధానము కూడా ఇంచుమించు సమానంగా ఉంటుంది. కానీ, "A"ని గ్రూప్ 10 మూలకాల ముందు వరకూ, గ్రూపు 10, తరువాత గ్రూపు లకు "B"ని వాడుతారు. ఈ రెండు పద్ధతులలో 8,9, 10 గ్రూపులను కలిసి కట్టుగా గ్రూప్ VII గా అభివర్ణిస్తారు.1988 లో కొత్త IUPAC నామకరణమును వాడుకలోకి తెచ్చారు.[14] ఈ గ్రూపులలో కొన్నింటికి సాధారణ పేర్లను (trivial/unsystematic names) ఆపాదించారు. గ్రూపు-3 నుండి గ్రూపు-10 వరకు ఎటువంటి సాధారణ పేర్లను పెట్టలేదు. వాటిని ఆ గ్రూపు సంఖ్యతో లేదా ఆ గ్రూపు లోని మొదటి మూలకం పేరు తోనో పిలుస్తారు. (ఉదా: గ్రూపు-3 ని స్కాండియం గ్రూపుగా పిలుస్తారు.)[13]
ఒకే గ్రూపులో ఉన్న మూలకాల పరమాణు వ్యాసార్థం, అయనీకరణ శక్మం, ఋణవిద్యుదాత్మకత వంటి ధర్మాలలో ఒక క్రమత్వం చూపుతాయి. ఒక గ్రూపులో పై నుండి కిందికి పోయేకొద్దీ పరమాణు పరిమాణం పెరుగుతుంది. పై నుండి కిందికి వచ్చే కొద్దీ ఒక్కొక్క కర్పరం పెరగడం వలన కేంద్రకం నుండి బాహ్య కక్ష్యకు మధ్య దూరం పెరుగుతుంది. పై నుండి కిందికి పోయే కొలదీ అయనీకరణ శక్యం (అయనీకరణ శక్తి) తగ్గుతుంది. దీనికి కారణం పై నుండి కిందికి వచ్చే కొలదీ పరమాణు పరిమాణం పెరగడం వలన బాహ్య కక్ష్య లోని ఎలక్ట్రాన్లకు, కేంద్రకానికి మధ్య ఆకర్షన బలం తగ్గడమే. దీని వల్ల బాహ్య కక్ష్యలోని ఒంటరి ఎలక్ట్రాన్ను తీసివేయడానికి తక్కువ శక్తి అవసరమవుతుంది. అదే విధంగా గ్రూపులలో పై నుండి కిందికి వచ్చే కొలదీ ఋణవిద్యుదాత్మకత తగ్గుతుంది. దీనికి కారణం వేలన్సీ ఎలక్ట్రాన్లకు, కేంద్రకానికి మధ్య దూరం పెరగడమే.[15] ఇందులో కొన్ని పరిమితులు ఉన్నాయి. ఉదాహరణకు 11వ గ్రూపులో ఋణవిద్యుదాత్మకత పై నుండి కిందికి పోయే కొద్దీ పెరుగుతుంది.[16]
| IUPAC group | 1a | 2 | n/a | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Mendeleev (I–VIII) | I | II | III | IV | V | VI | VII | VIII | I | II | III | IV | V | VI | VII | b | |||
| CAS (US, A-B-A) | IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |||
| old IUPAC (Europe, A-B) | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIII | IB | IIB | IIIB | IVB | VB | VIB | VIIB | 0 | |||
| Trivial name | H and Alkali metalsr | Alkaline earth metalsr | Coinage metals | Triels | Tetrels | Pnictogensr | Chalcogensr | Halogensr | Noble gasesr | ||||||||||
| Name by elementr | Lithium group | Beryllium group | Scandium group | Titanium group | Vanadium group | Chromium group | Manganese group | Iron group | Cobalt group | Nickel group | Copper group | Zinc group | Boron group | Carbon group | Nitrogen group | Oxygen group | Fluorine group | Helium or Neon group | |
| Period 1 | H | He | |||||||||||||||||
| Period 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||
| Period 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| Period 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Period 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Period 6 | Cs | Ba | La–Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Period 7 | Fr | Ra | Ac–No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
n/a Do not have a group number
b Group 18, the noble gases, were not discovered at the time of Mendeleev's original table. Later (1902), Mendeleev accepted the evidence for their existence, and they could be placed in a new "group 0", consistently and without breaking the periodic table principle.
r Group name as recommended by IUPAC.
పీరియడ్లు
మార్చుఆవర్తన పట్టికలో అడ్దువరుసలను పీరియడ్లు అంటారు. గ్రూపులు ముఖ్యమైన ఆవర్తన ధర్మములను కలిగి ఉన్నప్పటికీ, వాటికంటే అడ్డు వరుసలలోని కొన్ని ప్రాంతాలలో ముఖ్యమైన ఆవర్తన ధర్మాలున్నాయి. ఉదాహరణకు f-బ్లాకు మూలకాలైన లాంథనైడ్లు, ఆక్టినైడ్లు ఆవర్తన పట్టికలో దిగువన రెండు వరుసలలో అమర్చబడ్డాయి.[17]
ఒకే పీరియడులో ఉన్న మూలకాలలో పరమాణు వ్యాసార్థం, అయనీకరణ శక్మం, ఎలక్ట్రాన్ ఎఫినిటీ, ఋణవిద్యుదాత్మకత వంటి అంశాలలో ఆవర్తన ధర్మాలున్నాయి. ఒక పీరియడ్ లో ఎడమ నుండి కుడికి పోయినకొద్దీ పరమాణు వ్యాసార్థం తగ్గుతుంది. దీనికి కారణం ఒక పీరియడులో ఎడమ నుండి కుడికి పోయిన కొద్దీ ఒకే కక్ష్యలో ఎలక్ట్రాన్ల సంఖ్య పెరుతుతుంది. దీని వల్ల కేంద్రకానికి, బాహ్య కక్ష్యకు మద్య ఆకర్షణ బలం పెరిగడమే.[18] పేరియడ్లలో ఎడమ నుండి కుడికి పోయే కొలదీ పరమాణు పరిమాణం తగ్గడం వలన అయనీకరణ శక్మం పెరుగుతుంది. పరమాణు పరిమాణం తగ్గడం వలన కేంద్రకానికి, బాహ్యకక్ష్యలోని ఎలక్ట్రాన్ల మధ్య ఆకర్షణ బలం పెరుగుతుంది. అందువలన అయనీకరణ శక్మం పెరుగుతుంది. అయనీకరణ శక్మం వలెనే ఋణవిద్యుదాత్మకత కూడా పెరుగుతుంది.[15] అదే విధంగా పీరియడ్లలో ఎలక్ట్రాన్ ఎఫినిటీ కూడా కొద్దిగా మారుతుంది. ఉత్కృష్ట వాయువులు (జడ వాయువులు) తప్ప, లోహాలు (పీరియడ్ లో ఎడమవైపు) సాధారణంగా అలోహాల (పీరియడ్ లో కుడివైపు) కంటే తక్కువ ఎలక్ట్రాన్ ఎఫినిటీ కలిగి ఉంటాయి.[19]
బ్లాకులు
మార్చుఆవర్తన పట్టికలో వివిధ మూలకాల బాహ్య కక్ష్యలలో ఎలక్ట్రాన్ చేరే విధానం ఆధారంగా కొన్ని ప్రాంతాలను బ్లాకులుగా విభజించారు. బాహ్య కక్ష్యలో చివరి ఎలక్ట్రాన్ నిండే ఆర్బిటాల్ ఆధారంగా ఈ బ్లాకులకు నామకరణం చేసారు.[20][n 3] s-బ్లాకులో హైడ్రోజన్, హీలియంతో పాటు రెండు గ్రూపులు (క్షార లోహాలు, క్షార మృత్తిక లోహాలు) ఉంటాయి. p-బ్లాకులో 13 నుండి 18 గ్రూపులు (IIIA నుండి VIIIA) ఉంటాయి. d-బ్లాకు మూలకాలలో 3 నుండి 12 గ్రూపులు (IIIB నుండి IIB వరకు 10 గ్రూపులు ఉంటాయి. వీటిని పరివర్తన మూలకాలు అంటారు. f-బ్లాకు మూలకాలు ఆవర్తన పట్టికలో దిగువన రెండు వరుసలలో అమర్చబడి ఉంటాయి. ఇవి లాంథనైడ్లు, ఆక్టినైడు.[21]
వర్గాలు
మార్చుఆవర్తనపట్టికలోని మూలకాలు వాటి భౌతిక, రసాయన ధర్మాల ఆధారంగా లోహాలు, అలోహాలు, అర్ధలోహాలు అనే మూడు వర్గాలుగా వర్గీకరించారు. సాధారణంగా లోహాలు ఆవర్తన పట్టికలో ఎడమ వైపు, క్రింది భాగంలో ఉంటాయి. అవి ధ్యుతి (మెరిసే గుణం), అద్యధిక వాహకత కలిగి ఉండే ఘన పదార్థాలుగా ఉంటాయి. కొన్ని లోహాలు నిర్ధిష్ట నిష్పత్తిలో కలసి మిశ్రమలోహాలుగా ఏర్పడతాయి. సాధారణ ఉప్పు వంటి అయానిక పదార్థాలు అలోహాలు. అలోహాలు ఆవర్తన పట్టికలో కుడివైపున, పై భాగంలో ఉంటాయి. వాటిలో ఎక్కువగా రంగుకలవి లేదా రంగు లేని వాయువులుగా ఉండి సమయోజనీయ పదార్థాలను ఏర్పరుస్తాయి. లోహాలు, అలోహాల మధ్య భాగంలో అర్ధలోహాలు ఉంటాయి. అవి లోహ, అలోహ ధర్మలకు మధ్యస్థంగా, మిశ్రమ ధర్మాలను కలిగి ఉంటాయి.[22]
లోహాలు, అలోహాలు ఒకే విధమైన ఉప వర్గాలుగా వర్గీకరించబడి ఎడమ నుండి కుడి వైపుకి లోహ, అలోహ ధర్మాలను కలిగి ఉంటాయి. లోహాలు మరల అత్యంత చర్యాశీలత గల క్షారలోహాలు, తక్కువ చర్యశీలత గల క్షార మృత్తిక లోహాలు, లాంథనైడ్లు, ఆక్టినైడ్లుగా వర్గీకరించబడ్డాయి. అర్థ లోహాల వంటి పాలీ అటామిక్ నాన్మెటల్స్, కొన్ని లోహ ధర్మాలు కలిగిన అలోహాలు, ద్విపరమాణుక అలోహాలు, ఏక పరమాణుక ఉత్కృష్ట వాయువులుగా అలోహాలు వర్గీకరించబడ్డాయి.[23][24]
ఇతర సౌకర్యాలు, మార్పులు
మార్చుఆవర్తన పట్టికలో లాంథనైడ్లు, ఆక్టినైడ్లు రెండు అడ్డు వరుసలలో దిగువన అమర్చబడ్డాయి.[25] ఒక మూలకంతో ప్రతీ శ్రేణి (లాంథనం లేదా లుటేషియం, ఆక్టీనియం లేదా లారెన్షియం) తో ప్రారంభమవుతాయి. ఈ శ్రేణులు భేరియం, హాఫ్నియం మధ్య, రేడియం, రూథర్ఫర్డియం ల మధ్య అమరి ఉంటాయి. ఈ రెండు శ్రేణులు వరుసగా ఆరు, ఏడు పీరియడ్లకు చెందుతాయి.[26]
ఆవర్తన పోకడలు
మార్చుఎలక్ట్రాన్ విన్యాసం
మార్చుతటస్థ పరమాణువుల లోని కక్ష్యలలో ఉన్న ఎలక్ట్రాన్ల విన్యాసం ఆవర్తన ధర్మాన్ని కలిగి ఉంటుంది. పరమాణువులోని ఎలక్ట్రాన్లు ఎలక్ట్రాన్ కక్ష్యల శ్రేణుల (కక్ష్య 1, కక్ష్య 2 మొదలైనవి) లో చేరుతాయి. ప్రతీ కక్ష్య (కర్పరం) ఒకటి లేదా అంతకంటే ఎక్కువ ఉప కక్ష్యలను (s, p, d, f, g ) కలిగి ఉంటుంది. మాడెలంగ్ సూత్రం ప్రకారం పరమాణు సంఖ్య పెరుతున్న కొద్దీ ఎలక్ట్రాన్లు కక్షలు, ఉపకక్ష్యలలో చేరుతాయి. ఎడమవైపున ఉన్న మాడెలంగ్ సూత్రం ప్రకారం ఉన్న చిత్రంలోని ఆర్బిటాళ్ల ప్రకారం ఎలక్ట్రాన్లు వాటిలో చేరుతాయి. నియాన్ ఎలక్ట్రాన్ విన్యాసం 1s2 2s2 2p6. నియాన్ పరమాణు సంఖ్య 10. వాటిలో రెండు ఎలక్ట్రాన్లు మొదటి కక్ష్యలోని 1s ఆర్బిటాల్లో, ఎనిమిది ఎలక్ట్రాన్లు రెండవ కక్ష్యలోని 2s, 2p ఆర్బిటాళ్ళలో చేరుతాయి. రెండవ కక్ష్యలోని ఎనిమిది ఎలక్ట్రాన్లలో రెండు 2s ఆర్బిటాల్ లోనూ, ఆరు ఎలక్ట్రాన్లు 2p ఆర్బిటాల్ లోనూ చేరుతాయి. ఆవర్తన పట్టిక ప్రకారం ప్రతీ పీరియడు కొత్త కక్ష్యతో ప్రారంభమవుతుంది. కొత్త కక్ష్యలోని ఎలక్ట్రాన్ పీరియడులో మొదటి మూలకంలో మొదట చేరుతుంది. ఆవర్తన పట్టిక ఆధారంగా ప్రతీ పీరియడులో ఎలక్ట్రాన్లు హైడ్రోజన్, క్షారలోహంతో ప్రారంభమవుతుంది.[27][28] మూలకాల ధర్మాలు వాటి ఎలక్ట్రాన్ విన్యాసం ఆధారంగా ఉంటాయి. బాహ్యకక్ష్యలోని ఎలక్ట్రాన్ విన్యాసం ఒకే విధంగా ఉన్న మూలకాలన్నీ ఒకే విధమైన ధర్మాలను ప్రదర్శిస్తాయి. గ్రూపులలో ఉన్న మూలకాలు ఒకే విధమైన ఎలక్ట్రాన్ విన్యాసాన్ని బాహ్య కక్ష్యలో ఉన్నందున అవి ఆవర్తన ధర్మాలను కలిగి ఉంటాయి. ప్రక్క పటంలో వివిధ కక్ష్యలలోని ఆర్బిటాళ్ళు ఒక శక్తి క్రమంలో అమర్చబడి ఉన్నాయి. ఈ ఆర్బిటాళ్ల వరుస క్రమంలో ఎలక్ట్రాన్లు చేరుతాయి. s, p, d, f, g ఆర్బిటాళ్లలో గరిష్ఠంగా నింపగల ఎలక్ట్రాన్ల సంఖ్యలు వరుసగా 2, 6, 10,14, 18 ఉంటాయి. ఎలక్ట్రాన్ విన్యాసం ఆధారంగా మూలకాలు వివిధ ఆవర్తన ధర్మాలను కలిగి ఉంటాయి.[27][28]
పరమాణు వ్యాసార్థం
మార్చుపరమాణు వ్యాసార్థం ఆవర్తన పట్టికలో గ్రూపులు,పీరియడ్లలో ఒక క్రమంలో మారుతుంది. ప్రతీ పీరియడ్ లో ఎడమ నుండి కుడికి పోయే కొద్దీ పరమాణు వ్యాసార్థం తగ్గుతుంది. పీరియడ్ క్షారలోహంతో ప్రారంభమై ఉత్కృష్ట వాయువుతో అంతమవుతుంది. ఒకే పీరియడులో ఎలక్ట్రాన్లు క్రమంగా పెరగడం వల్ల పరమాణు కేంద్రకానికి, బాహ్య కక్ష్యలోని ఎలక్ట్రాన్లకు మధ్య ఆకర్షణ బలం పెరగడం వల్ల పరమాణు వ్యాసార్థం క్రమంగా తగ్గుతుంది. అదే విధంగా గ్రూపులలో పై నుండి క్రిందికి వచ్చే కొద్దీ పరమాణు పరిమాణం పెరుగుతుంది. గ్రూపులలో క్షారలోహాలు, జడవాయువులలో పరమాణు వ్యాసార్థం వేగంగా పెరుగుతుంది. ఈ పరమాణు వ్యాసార్థాల ఆవర్తన పోకడలను ఎలక్ట్రాన్ కర్పర సిద్ధాంతం (ఎలక్ట్రాన్ షెల్ థియరీ) ఆధారంగా వివరించవచ్చు. ఆ సిద్ధాంతం క్వాంటం సిద్ధాంతాన్ని ఋజువు చేయడానికి, అభివృద్ధికి ముఖ్యమైన సాక్ష్యాలను అందిస్తుంది.[29] 4f- ఉపకక్ష్యలో ఎలక్ట్రాన్లు సీరియం (Z = 58) నుండి లుటేషియం (Z = 71) వరకు క్రమంగా నిండుతాయి. కేంద్రకంపై బాహ్య కక్ష్య ఆకర్షణ బలం పెరగడానికి షీల్డింగ్ గా పనిచేస్తుంది. లాంథనైడ్లలో ప్రారంభమైన మూలకాల పరమాణు వ్యాసార్థాలు మనం అనుకున్న దానికన్నా భిన్నంగా ఒకే విధంగా ఉంటాయి.[30] అందువలన హాఫ్నియం, జిర్కోనియం ల పరమాణు వ్యాసార్థాలు, టాంటాలం, నియోబియం ల పరమాణు వ్యాసార్థలు సమానంగా ఉంటాయి. దీనిని లాంథనైడ్ సంకోచం అంటారు. ఈ లాంతనైడ్ సంకోచం ప్రభావం ప్లాటినం (Z = 78) వరకు గుర్తించబడింది. తరువాత దీనిపై "జడ జంట ప్రభావం" అని పిలువబడే సాపేక్ష ప్రభావం ఉంటుంది.[31] ఇదే విధంమైన ప్రభావం "డి-బ్లాకు సంకోచం" కూడా డి-బ్లాకు, పి-బ్లాకు మధ్య ఉంటుంది. ఇది లాంథనైడ్ సంకోచం లాంటి కారణంగా ఉన్నప్పటికీ దాని కంటే తక్కువగాఉంటుంది.[30]
అయనీకరణ శక్మము
మార్చుమొదటి అయనీకరణ శక్మము అనగా పరమాణువు నుండి ఒక ఎలక్ట్రాన్ తొలగించుటకు కావలసిన కనీస శక్తి. రెండవ అయనీకరణ శక్మం అనగా పరమాణువు నుండి రెండవ ఎలక్ట్రాన్ ను తొలగించుటకు కావలసిన శక్తి. ఇచ్చిన పరమాణువుకు వరుస అయనీకరణ శక్తులు వాటి అయనీకరణ స్థాయిల వలన పెరుగుతాయి. ఉదాహరణకు మెగ్నీషియం మొదటి అయనీకరణ శక్తి 738 కిలోజౌల్/మోల్, రెండవ అయనీకరణ శక్తి 1450 కిలోజౌల్/మోల్. పరమాణువులో కేంద్రకానికి దగ్గరగా ఉన్న కక్ష్యలలోని ఎలక్ట్రాన్లకు, కేంద్రకానికి మధ్య స్థిర విద్యుదాకర్షణ బలం ఉంటుంది. అందువలన ఆ కక్ష్యలోని ఎలక్ట్రాన్ ను తొలగించాలంటే ఎక్కువ శక్తి కావాలి. ఆవర్తన పట్టికలో పీరియడ్లో ఎడమ నుండి కుడికి పోయే కొలదీ అయనీకరణ శక్తి పెరుగుతుంది.[31] దీనికి కారణం పరమాణు పరిమాణం తగ్గడమే.
జడవాయువుల (బాహ్య కక్ష్యలో పూర్తి ఎలక్ట్రాన్లు కలవి) పరమాణువుల నుండి బాహ్య కక్ష్యలోని ఎలక్ట్రాన్ తీసివేయుటకు మోలార్ అయనీకరణ శక్తులలో ఎక్కువ తేడా కనిపిస్తుంది. ఉదాహరణకు మెగ్నీషియం మొదటి, రెండవ అయనీకరణ శక్మములలో ఎలక్ట్రాన్లు 3s ఆర్బిటాల్ నుండి తొలగించబడినాయి. మూడవ అయనీకరణ శక్తి 7730 కిలోజౌల్/మోల్ ఉంటుంది. మూడవ అయనీకరణ శక్తి విషయంలో ఎలక్ట్రాన్ ను అష్టక విన్యాసం పొంది నియాన్ ఎలక్ట్రాన్ విన్యాసం పొందినటువంటి మెగ్నీషియంఅయాన్ (Mg2+) లోని 2p ఆర్బిటాల్ నుండి ఎలక్ట్రాన్ ను తొలగించాలంటే ఎక్కువశక్తి అవసరం. అందువలన ఈ శక్తి అధికమవుతుంది.[31]
ఋణవిద్యుదాత్మకత
మార్చుపరమాణువు ఎలక్ట్రాన్లను ఆకర్షించే స్వభావాన్ని ఋణవిద్యుదాత్మకత అంటారు.[32] పరమాణు ఋణవిద్యుదాత్మకత దాని పరమాణుసంఖ్య, కేంద్రకానికి, వేలన్సీ ఎలక్ట్రాన్లకు మధ్య ఉండే దూరం పై ప్రభావితమవుతుంది. పరమాణువు ఎక్కువ ఎలక్ట్రాన్లను ఆకర్షించే స్వభావం ఉంటే అధిక ఋణవిద్యుదాత్మకత ఉంటుంది. దీనిని మొట్టమొదట లైనస్ పాలింగ్ 1932లో ప్రతిపాదించాడు.[33] సాధారణంగా ఋణవిద్యుదాత్మకత పీరియడ్లలో ఎడమ నుండి కుడికి పోయే కొద్దీ పెరుగుతుంది. గ్రూపులలో పై నుండి క్రిందికి వచ్చే కొలదీ తగ్గుతుంది. అందువలన ఇప్పుడు అందుబాటులో ఉన్న సమాచారం ఆధారంగా ఫ్లోరిన్కు అన్ని మూలకాల కంటే ఎక్కువ ఋణవిద్యుదాత్మకత,[n 5] సీసియంకు అత్యల్ప ఋణవిద్యుదాత్మకత ఉంటుంది.[16]
ఈ సాధారణ నియమానికి కొన్ని మినహాయింపులు ఉన్నాయి. d-బ్లాకు సంకోచం కారణంగా గాలియం, జెర్మేనియం లకు అల్యూమినియం, సిలికాన్ ల కంటే ఎక్కువ ఋణవిద్యుదాత్మకత విలువలు ఉన్నాయి. పరివర్తన లోహాల మొదటి వరుస తర్వాత వెంటనే నాల్గవ నిలువు వరుస లోని మూలకాలు అసాధారణంగా తక్కువ పరమాణు వ్యాసార్థాలను కలిగి ఉంటాయి, ఎందుకంటే 3 డి-ఎలక్ట్రాన్లు పెరిగిన కేంద్రక ఆవేశాన్ని షీల్డింగ్ చేయడంలో ప్రభావవంతంగా ఉండవు. తక్కువ పరమాణు పరిమాణం ఎక్కువ ఋణవిద్యుదాత్మకతను కలిగి ఉంటుంది.[16]
ఎలక్ట్రాన్ ఎఫినిటీ
మార్చుఒక తటస్థ పరమాణువు ఋణ అయాన్ (ఆనయాన్) ఏర్పడేటప్పుడు ఎలక్ట్రాన్ దాని కక్ష్యలోనికి చేరుతుంది. అపుడు విడుదలయ్యే శక్తిని ఎలక్ట్రాన్ ఎఫినిటీ అంటారు. ఎలక్ట్రాన్ ఎఫినిటీ విలువలలో చాలా తేడాలు ఉన్నప్పటికీ కొన్ని నమూనాలు తయారు చేయబడ్డాయి. సాధారణంగా అలోహాలు లోహాల కంటే ఎక్కువ ధనాత్మక ఎలక్ట్రాన్ ఎఫినిటీ విలువలను కలిగి ఉంటాయి. క్లోరిన్ అదనపు ఎలక్ట్రాన్ ను ఆకర్షించే ప్రవృత్తి ఎక్కువగా కలిగి ఉంటుంది. జడ వాయువుల ఎలక్ట్రాన్ విలువలను కొలవలేదు. అందువలన అవి కొద్ది ఋణ విలువలను కలిగి ఉండవచ్చు లేదా ఉండక పోవచ్చు.[36]
పీరియడ్లలో ఎడమ నుండి కుడికి పోయే కొద్దీ ఎలక్ట్రాన్ ఎఫినిటీ విలువలు పెరుగుతాయి. దీనికి కారణం వేలన్సీ కక్ష్యలో ఎలక్ట్రాన్లు నిండడమే. ఎలక్ట్రాన్లను ఆకర్షించేటప్పుడు ఆవర్తన పట్టికలో 17వ గ్రూపు మూలకాలు 1వ గ్రూపు మూలకాల కంటే ఎక్కువ శక్తిని విడుదల చేస్తాయి. దీనికి కారణం వేలన్సీ కక్ష్య నిందడం వలన అధిక స్థిరత్వం పొందుతాయి.[36]
గ్రూపులలో పై నుండి కిందికి వచ్చే కొలదీ ఎలక్ట్రాన్ ఎఫినిటీ తగ్గుతుంది. పై నుండి కిందికి వచ్చేకొద్దీ కక్ష్యలు పెరగడం వలన కేంద్రకానికి దూరంగా ఉన్న కక్ష్యలలో అదనపు ఎలక్ట్రాన్ చేరడం వల్ల కేంద్రకాకర్షణ తక్కువ ఉంటుంది. అందువలన తక్కువ శక్తి విడుదల అవుతుంది. గ్రూపులలో క్రిందికి వచ్చే కొలదీ మూడింట ఒక వంతు మూలకాలు క్రమ రహితమైన ఎలక్ట్రన్ ఎఫినిటీ విలువలను కలిగి ఉంటాయి. గ్రూపు 1 మూలకాలలో ఎలక్ట్రాన్ ఎఫినిటీ విలువలు క్రమంగా తగ్గుతాయి.[37]
లోహ ధర్మం
మార్చుతక్కువ అయనీకరణ శక్మం, ఋణవిద్యుదాత్మకత, ఎలక్ట్రాన్ ఎఫినిటీ ఉన్న మూలకాలు అత్యధిక లోహ ధర్మాలను ప్రదర్శిస్తాయి. అదే విధంగా అలోహ ధర్మం గల మూలకాలకు ఎక్కువ అయనీకరణ శక్మం, ఋణవిద్యుదాత్మకత, ఎలక్ట్రాన్ ఎఫినిటీ విలువలు ఉంటాయి.[38] పీరియడ్లలో ఎడమ నుండి కుడికి పోయే కలదీ లోహ స్వభావం తగ్గుతుంది. d,f ఆర్బిటాళ్ళలోణి ఎలక్ట్రాన్లకు తక్కువ స్క్రీనింగ్ ప్రభావం ఉండటం వలన కొన్ని అసంగతాలు కూడా ఉన్నాయి.[39] గ్రూపులలో పై నుండి కిందికి పోయే కొలదీ లోహ స్వభావం పెరుగుతుంది. అందువలన ఎక్కువ లోహ ధర్మం గల మూలకాలు ( సీసియం, ఫ్రాన్సియం) లు ఆవర్తన పట్టికలో ఎడమవైపు కింది భాగంలో ఉంటాయి. అధిక అలోహ స్వభావం గల మూలకాలు (ఆక్సిజన్, ఫ్లోరిన్, క్లోరిన్) ఆవర్తన పట్టికలో పై భాగంలో కుడి వైపున ఉంటాయి. అడ్డు, నిలువు వరుసల ధర్మాల సమ్మేళనం ఆవర్తన పట్టికలో లోహ, అలోహాలను వేరుచేసే మెట్ల వంటి అమరిక వివరిస్తుంది. ఆ రేఖకు ప్రక్కన గల మూలకాలు అర్థ లోహాలు.[40][41]
చరిత్ర
మార్చుమొదటి వ్యవస్థీకృత ప్రయత్నాలు
మార్చు1789లో ఆంటోనీ లావోయిజర్ 33 రసాయన మూలకాలను వాయువులు, లోహాలు, అలోహాలు, ఎర్త్లు (లోహ ఆక్సైడ్లు) గా వర్గీకరించి ప్రచురించాడు.[42] రసాయన శాస్త్రవేత్తలు తరువాతి శతాబ్దంలో మరింత కచ్చితమైన వర్గీకరణ పథకం కోసం శోధించసాగారు. 1829లో జోహన్ వోల్ఫ్గాంగ్ డాబర్నీర్ మూలకాల రసాయన ధర్మాల ఆధారంగా మూడేసి మూలకాల సమూహాలు (త్రికములు) ప్రదిపాదించాడు. లిథియం, సోడియం, పొటాషియం ఒక త్రికము. ఇవి మూడు కూడా అత్యధిక చర్యాశీలత కల మూలకాలు. ఈ త్రికములలో మధ్య మూలకం పరమాణు భారం మొదటి, మూడవ మూలకాల పరమాణు భారాల సరాసరికి ఇంచుమించు సమానంగా ఉండటాన్ని అతను గుర్తించాడు.[43] ఇది "త్రిక సిద్ధాంతం"గా పిలువబడింది.[44] 1843లో జర్ననీకి చెందిన రసాయన శాస్త్రవేత్త లియోపోల్డ్ జి.మెలిన్ పది త్రికాలను గుర్తించాడు. వాటిని నాలుగు మూలకాల చొప్పున మూడు సమూహాలు, ఐదు మూలకాల చొప్పున ఒక సమూహాన్ని ఏర్పరచాడు. 1857లో జీన్-బాప్టిస్ట్ డూమస్ లోహాలలో వివిధ సమూహాల మధ్య సంబంధాన్ని ప్రచురించాడు. వివిధ రసాయన శాస్త్రవేత్తలు మూలకాల చిన్న సమూహాల మధ్య సంబంధాలను గుర్తించగలిగినప్పటికీ వాటన్నింటికీ కలుపుకొని ఒక విధానాన్ని రూపకల్పన చేయలేక పోయారు.[43]
1856 లో జర్మనీ రసాయన శాస్త్రజ్ఞుడు ఆగస్టు కెకులే కార్బన్ మూలకం పరమాణువు నాలుగు ఇతర పరమాణువులతో కలసి ఉన్నట్లు గుర్తించాడు. ఉదాహరణకు మీథేన్లో కార్బన్ పరమాణువు నాలుగు హైడ్రోజన్ పరమాణువులతో కలసి ఉంది. ఈ భావన తరువాతి కాలంలో సంయోజకత (వేలన్సీ) గా పిలువబడింది. వివిధ మూలకాలు వివిధ పరమాణువులతో కలసి ఉంటాయి.[45]
1862లో "అలెక్జాండ్రె-ఎమిలి బెగుయెర్ డి చాన్కోర్టోయిస్" అనే ఫ్రెంచ్ భూగోళ శాస్త్రజ్ఞుడు ఆవర్తన పట్టికకు ప్రారంభ రూపాన్ని ప్రచురించాడు. దీనిని టెల్లూరిక్ హెలిక్స్ లేదా స్క్రూగా పిలుస్తారు. మూలకాల యొక్క ఆవర్తనతను గమనించిన వ్యక్తులలో అతను మొదటివాడు. ఒక స్థూపాకారం పై వర్తులాకారంగా మూలకాలను వాటి పరమాణు భారాల ఆరోహణ క్రమంలో అమర్చినపుడు క్రమ అవధులలో ఒకే ధర్మలున్న మూలకాలన్నీ ఒకే వరుసలలో ఉండటాన్ని అతను గమనించాడు. అతను తయారుచేసిన ఛార్టులో కొన్ని అయాన్లు, సమ్మేళనాలు కూడా మూలకాలతో పాటు ఉన్నాయి. అతను తయారుచేసిన పత్రంలో రసాయన పదాలు కాకుండా భూగర్భ పదార్థల పదాలను వాడాడు. అతను రేఖా చిత్రాన్ని చేర్చలేదు. దీని ఫలితంగా డిమిట్రీ మెండలీవ్ ఆవర్తన పట్టికను తయారుచేసే వరకు ఈ చిత్రం ఎవరినీ ఆకర్షించలేక పోయింది.[46]
1864లో జర్మనీ రసాయన శాస్త్రవేత్త జూలియస్ లోథర్ మేయర్ 44 మూలకాలను వాటి సంయోజకత (వేలన్సీ) ఆధారంగా అమర్చి ఒక పట్టికను ప్రచురించాడు. ఈ పట్టిక సారూప్య లక్షణాలతో ఉన్న మూలకాలన్నీ తరచూ ఒకే వేలన్సీని కలిగి ఉంటాయని చూపించింది.[47] తరువాత విలియం ఓడ్లింగ్ (ఇంగ్లీషు రసాయన శాస్త్రవేత్త) 57 మూలకాలను వాటి పరమాణు భారాల ఆధారంగా అమర్చి ప్రచురించాడు. దీనిలో కొన్ని అక్రమ అమరికలు, ఖాళీలు ఉన్న ఈ పట్టికలో, మూలకాల పరమాణు భారాలు ఆవర్తనంగా కనిపించడాన్ని అతను గమనించాడు. మూలకాలు "వాటి సాధారణ గ్రూపులలో అమరిక"ను ఉన్నట్లు గుర్తించాడు.[48] ఓడ్లింగ్ ఒక ఆవర్తన నియమానికి సంబంధిచిన ఆలోచనను సూచించినప్పటికీ దానిని కొనసాగించలేదు.[49] అతంతరం అతను 1870లో మూలకాల వేలన్సీ-ఆధారిత వర్గీకరణను ప్రతిపాదించాడు.[50]
ఇంగ్లీషు రసాయన శాస్త్రవేత్త జాన్ న్యూలాండ్స్ 1863 నుండి 1866 వరకు పరిశోధనా పత్రాలను తయారుచేసాడు. అతని ప్రతిపాదన ప్రకారం మూలకాలను వాటి పరమాణు భారాల ఆరోహణ క్రమంలో అవర్చినపుడు మూలకాల భౌతిక, రసాయన ధర్మాలు ఎనిమిది మూలకాల వ్యవధిలో ఆవర్తనమవుతాయి. అతను ఈ ధర్మాన్ని సంగీత స్వరాలలో ఉన్న ఆవర్తన క్రమమైన (సరిగమపదనిస) అష్టకంతో పోల్చాడు.[51][52] అందువలన ఈ అమరికను న్యూలాండ్స్ అష్టక పరికల్పన అంటారు. అయినప్పటికీ అతని పరికల్పన తన సమకాలీనులచే ఎగతాళి చేయబడింది. కెమికల్ సొసైటీ అతని రచనలను ప్రచురించడానికి నిరాకరించింది.[53] ఏదేమైనప్పటికీ అతను ఒక ఆవర్తన పట్టికను రూపొందించగలిగాడు. అతను తయారుచేసిన ఆవర్తన పట్టికలో జెర్మేనియం వంటి మూలకాల ఉనికిని ముందుగా ఊహించి ఖాళీ స్థానాలనుంచాడు.[54] కెమికల్ సొసైటీ మెండలీవ్కు ఆవర్తన పట్టిక రూపొందించిన ఘనత ఇచ్చిన ఐదు సంవత్సరాల తరువాత మాత్రమే న్యూలాండ్స్ ఆవిష్కరణల ప్రాముఖ్యతను అంగీకరించింది.[55]
డేనిష్ దేశంలో జన్మించి అమెరికాలో ఉన్న రసాయన శాస్త్రవేత్త "గుస్టావస్ హిన్రిచెస్" 1867లో పరమాణు వర్ణపటం, పరమాణు భారాలు, రసాయన సారూప్యతలను ఆధారంగా చేసుకొని సర్పిలాకార ఆవర్తన వ్యవస్థను ప్రచురించాడు. అతని పనిని వివేకవంతమైన, ఆశ్చర్యకరమైన, చిక్కైనదిగా పరిగణించారు కానీ దానికి గుర్తింపునివ్వడానికి, అంగీకరించడానికి వ్యతిరేకించారు.[56][57]
రష్యన్ రసాయన శాస్త్రవేత్త డిమిట్రీ మెండలియెవ్ 1869లో, జర్మన్ రసాయన శాస్త్రవేత్త జూలియస్ లోథర్మేయర్ 1870లో వేర్వేరుగా ఆవర్తన పట్టికలను రూపొందించారు.[58] ఇద్దరూ తమ తమ ఆవర్తన పట్టికలలో మూలకాలను నిలువు వరుసలు, అడ్డు వరుసలలో వాటి పరమాణు భారాల ఆరోహణ క్రమంలో అమర్చి తయారు చేసారు. ఆవర్తన ధర్మల ఆధారంగా నిలువు వరుసలలో మూలకాలను అమర్చారు.[59] మెండలీవ్ పట్టికకు లభించిన గుర్తింపు, అంగీకారం అతను తీసుకున్న రెండు నిర్ణయాల నుండి వచ్చింది. మొదటిది అతను సరైన ధర్మాలు గల అప్పటికి కనుగొనని మూలకాలు స్థానాలలో ఖాళీలనుంచాడు.[60] మెండెలీవ్ ఊహించినట్లుగా సరిగ్గా ఎకా సిలికాన్, (జెర్మేనియం), ఎకా అల్యూమినియం, (గాలియం), ఎకాబోరాన్ (స్కాండియం) మూలకాలు కనుగొనడం వలన మెండలీవ్కు అత్యధికంగా గుర్తింపు వచ్చింది. కొందరయితే మెండలీవ్ చెప్పినట్లుగా ఇంకా చాలా క్రొత్త మూలకాలు కనుగోవడం భ్రమ అని కొట్టిపారేశారు కాని Ga (గాలియం), Ge (జెర్మేనియం) మూలకాలను 1875లోను, 1886లోను సరిగ్గా మెండలీవ్ చెప్పిన ఖాళీలలో కనుగొన్నారు.[61] రెండవ నిర్ణయం అప్పుడప్పుడు ప్రక్క ప్రక్క మూలకాల పరమాణు భారాల ఆరోహణ క్రమాన్ని విస్మరించి ఆ మూలకాల క్రమాన్ని మార్చడం. ఒక మూలకం యొక్క లక్షణాలను బట్టి, దానికి ముందు వెనుకల ఉన్న మూలకాల పరమాణు భారాలను బట్టి, దాని పరమాణుభారం అంచనాను మార్చుకొనవచ్చును. ఉదాహరణకు టెల్లీరియం పరమాణు భారం 123, 126 మధ్య ఉండాలి. 128 కారాదు. (ఇక్కడ మెండలియెవ్ అంచనా తప్పింది. టెల్లూరియం పరమాణుభారం 127.6, ఇది అయొడీన్ పరమాణు భారమైన 126.9 కంటే ఎక్కువ.)
పరమాణు భారాలను ఉపయోగించి మూలకాలను నిర్వహించడానికి, అతని సమయంలో న్యాయమైన కచ్చితత్వానికి నిర్ణయించదగిన సమాచారంతో మెండలీవ్ 1869 లో ప్రచురించాడు. తప్పిపోయిన మూలకాల యొక్క లక్షణాలను కచ్చితంగా అంచనా వేయడానికి మెండలీవ్కు పరమాణు భారం బాగా పనిచేసింది. మెండలీవ్ సంస్కృత సంఖ్యలను ఎకా (1), ద్వి (2), త్రి (3) లను తప్పిపోయిన మూలకాలకు పేరు పెట్టడానికి ఉపయోగించాడు. మెండలీవ్, అలా చేయడం ద్వారా, ప్రాచీన సంస్కృత వ్యాకరణవేత్తలకు, ప్రత్యేకించి పాణినికి నివాళులర్పించారని తెలుస్తుంది.[62]
1911లో ఎర్నెస్ట్ రూథర్ఫోర్డ్ చేత పరమాణు కేంద్రకం కనుగొనబడిన తరువాత, కేంద్రక ఆవేశం యొక్క పూర్ణాంక సంఖ్య ఆవర్తన పట్టికలోని ప్రతి మూలకం యొక్క వరుస స్థానానికి సమానంగా ఉంటుందని ప్రతిపాదించబడింది. 1913 లో, ఇంగ్లీష్ భౌతిక శాస్త్రవేత్త హెన్రీ మోస్లే ఎక్స్-కిరణ వర్ణపటాన్ని ఉపయోగించి ఈ ప్రతిపాదనను ప్రయోగాత్మకంగా ధ్రువీకరించాడు. ప్రతి మూలకం కేంద్రక ఆవేశం విలువను మోస్లే నిర్ణయించాడు. మెండలీవ్ ఉపయోగించిన క్రమం వాస్తవానికి కేంద్రక ఆవేశం ద్వారా మూలకాలను వరుస క్రమంలో ఉంచుతుందని చూపించాడు.[63] కేంద్రక ఆవేశం ప్రోటాన్ సంఖ్యతో సమానంగా ఉంటుంది. ఇది ప్రతి మూలకం పరమాణు సంఖ్య (Z) విలువను నిర్ణయిస్తుంది. పరమాణు సంఖ్యను ఉపయోగించడం మూలకాలకు కచ్చితమైన, పూర్ణాంక - ఆధారిత క్రమాన్ని ఇస్తుంది. 1913 లో అల్యూమినియం (Z = 13), బంగారం (Z = 79) మధ్య ఇంకా లేని పరమాణు సంఖ్యలు Z = 43, 61, 72, 75 గల మూలకాలను మోస్లే ఊహించాడు. తరువాత అవి కనుగొనబడ్డాయి. పరమాణు సంఖ్య ఒక మూలకానికి సంపూర్ణ నిర్వచనం, ఆవర్తన పట్టికలో స్థానం కోసం వాస్తవిక ఆధారాన్ని ఇస్తుంది.[64]
రెండవ సంస్కరణ, మరింత అభివృద్ధి
మార్చు1871 లో, మెండలీవ్ తన ఆవర్తన పట్టికను కొత్త రూపంలో ప్రచురించాడు. సారూప్య మూలకాల సమూహాలను అడ్డువరుసలలో కాకుండా నిలువు వరుసలలో అమర్చాడు. ఆ నిలువు వరుసలు మూలకం యొక్క ఆక్సీకరణ స్థితికి అనుగుణంగా I నుండి VIII వరకు ఉంటాయి. అతను అతను ఇంతకుముందు లేని మూలకాల లక్షణాల గురించి వివరణాత్మక అంచనాలను కూడా ఇచ్చాడు.[65] మూలక లక్షణాలకు అనుగుణంగా ఆయా స్థానాలలో ఉండవలసిన మూలకాల వద్ద ఖాళీలను ఉంచాడు. రసాయన శాస్త్రవేత్తలు సహజంగా సంభవించే అదనపు మూలకాలను కనుగొన్నందున ఈ అంతరాలు తరువాత నిండిపోయాయి.[66] శాస్త్రవేత్తలు 1939లో సహజంగా కనుగొనబడిన చివరి మూలకం ఫ్రాన్షియం (మెండలీవ్ చేత ఎకా-సీసియం అని పిలుస్తారు).[67] ప్లూటోనియం, 1940 లో కృత్రిమంగా ఉత్పత్తి చేయబడింది. ఇది 1971 లో సహజంగా లభించే మూలకంగా గుర్తించబడింది.[68] సాధారణంగా ఆవర్తన పట్టిక లేఅవుట్ను సాధారణ లేదా ప్రామాణిక రూపం అని కూడా పిలుస్తారు. ఇది హోరేస్ గ్రోవ్స్ డెమింగ్కు ఆపాదించబడింది.[69] 1923 లో, డెమింగ్ అనే అమెరికన్ రసాయన శాస్త్రవేత్త చిన్న (మెండలీవ్ పద్ధతి ), మధ్యస్థ (18-నిలువు వరుసలు) ఆవర్తన పట్టికను ప్రచురించాడు.[70][n 6] మెర్క్ అండ్ కంపెనీ 1928 లో డెమింగ్ తయారుచేసిన 18-నిలువువరుసల ఆవర్తన పట్టిక కరపత్ర రూపాన్ని తయారు చేసింది. ఇది అమెరికన్ పాఠశాలల్లో విస్తృతంగా పంపిణీ చేయబడింది. 1930 ల నాటికి డెమింగ్ ఆవర్తన పట్టిక కరపత్రం రసాయనశాస్త్ర విజ్ఞానసర్వస్వంలో కనిపిస్తుంది. దీనిని సార్జెంట్-వెల్చ్ సైంటిఫిక్ కంపెనీ కూడా చాలా సంవత్సరాలు పంపిణీ చేసింది.[71][72][73]
నవీన క్వాంటం మెకానిక్ సిద్ధాంతం అభివృద్ధి తరువాత పరమాణువుల ఎలక్ట్రాన్ విన్యాసాల ఆధారంగా ఒక పీరియడ్ (అడ్డు వరుస) లో ఎడమ నుండి కుడికి పోయే కొలది ఒక్కొక్క ఎలక్ట్రాన్ చొప్పున కక్ష్యలోకి చేరుతుంది. పెద్ద పరమాణువులకు ఎక్కువ ఉప కక్ష్యలు ఉంటాయి. అందువల్ల పట్టికలో పెద్ద పీరియడ్లు ఏర్పడతాయి.[74]
1945లో అమెరికన్ శాస్త్రవేత్త గ్లెన్ సీబోర్గ్ ఆక్టినైడ్ మూలకాలు లాంథనైడ్ మూలకాల వలె ఉంటాయని సూచించాడు. లాంథనైడ్లు, ఆక్టినైడ్లలో f ఉపస్థాయి (ఆర్బిటాళ్) లో చివరి ఎలక్ట్రాంచేరుతుంది. అంతకు ముందు ఆక్టినైడ్లు నాల్గవ డి-బ్లాకు వరుసలో ఉన్నట్లు ఆలోచించేవారు. సీబోర్గ్ సహచరులు అతని వృత్తిని నాశనం చేసే అవకాశం ఉన్నందున అటువంటి తీవ్రమైన సూచనను ప్రచురించవద్దని సలహా ఇచ్చారు. సీబోర్గ్ తనకు అప్రతిష్ఠ కలిగించే అంశం లేదని భావించి, ఎలాగైనా తన ఆలోచనలను ప్రచురించాడు. సీబోర్గ్ యొక్క సూచన సరైనదని తేలింది. తరువాత అతను యాక్టినైడ్ మూలకాలను సంశ్లేషణ చేయడంలో చేసిన కృషికి రసాయన శాస్త్రంలో 1951 నోబెల్ బహుమతిని గెలుచుకున్నాడు.[75][76][n 7]
యురేనియం పరమాణుసంఖ్యను మించిన సంఖ్యగల మూలకాలు సహజంగా కొద్ది పరిమాణంలో లభిస్తున్నప్పటికీ,[6] అవి అన్నీ ప్రయోగశాలలో కనుగొనబడినవి. వాటి ఉత్పత్తి వలన ఆవర్తన పట్టికను గణనీయంగా విస్తరించింది. వీటిలో మొదటిది నెప్ట్యూనియం 1939 లో సంశ్లేషణ చేయబడింది.[77] యురేనియం పరమాణుసంఖ్యను మించిన సంఖ్యగల అనేక మూలకాలు అస్థిరంగా ఉండి త్వరగా విఘటనం చెందుతున్నందువల్ల ఉత్పత్తి చేసినప్పుడు వాటిని గుర్తించడం, వర్గీకరించడం సవాలుగా మారింది. కొన్ని మూలకలకు పోటీ ఆవిష్కరణల దావాలను అంగీకరించడం,, ఏ వర్గానికి ప్రాధాన్యత ఉందో తెలుసుకోవడానికి స్వతంత్ర సమీక్ష అవసరం. అందువల్ల హక్కుల పేరు పెట్టడం గురించి వివాదాలు ఉన్నాయి.[78] 2010 లో, రష్యాలోని మాస్కో ఓబ్లాస్ట్లోని డబ్నాలో ఉమ్మడి రష్యా-యుఎస్ సహకారం టెన్నెస్సిన్ (ఎలిమెంట్ 117) యొక్క ఆరు అణువులను సంశ్లేషణ చేసినట్లు పేర్కొంది, ఇది ఇటీవల పేర్కొన్న ఆవిష్కరణ.2016 నవంబరు 28న ఇటీవల నామీకరణ చేయబడిన మూలకాలు నిథోనియం (పరమాణు సంఖ్య 113), మాస్కోవియం (పరమాణు సంఖ్య 115), ఒగనేస్సన్ (పరమాణు సంఖ్య 118).[79]
వివిధ ఆవర్తన పట్టికలు
మార్చుపొడవైన 32-నిలువు వరుసల పట్టిక
మార్చుఆవర్తన పట్టికలో దిగువన ఉన్న f-బ్లాకు మూలకాలను వాటి వాస్తవ ప్రదేశాలలో s-బ్లాకు, d-బ్లాకు మూలకాల మధ్య ఉంచి 32 నిలువు వరుసలు గల నవీన ఆవర్తన పట్టికను ఆల్ఫ్రెడ్ వెర్నెర్ ప్రతిపాదించాడు.[80] 18- నిలువు వరుసల రూపం వలె కాకుండా, ఈ అమరిక "పెరుగుతున్న అణు సంఖ్యల క్రమంలో ఎటువంటి ఆటంకాలు లేవు".[81] ఆవర్తన పట్టికలోని ఇతర బ్లాక్లకు, ఎఫ్-బ్లాక్ యొక్క సంబంధం కూడా చూడటం సులభం అవుతుంది.[82] లాంతనైడ్లు, ఆక్టినైడ్లు విద్యార్థుల మనస్సులలో నిస్తేజమైన, అప్రధానమైన మూలకాలుగా పరిగణించబడి, విస్మరించబడతాయనే అనే కారణంతో 32 నిలువు వరుసలతో కూడిన పట్టిక రూపాన్ని విలియం.బి.జెన్సెన్ సమర్థించాడు.[83] ఈ ప్రయోజనాలు ఉన్నప్పటికీ, 32-నిలువు వరుసల రూపాన్ని సాధారణంగా పుస్తక పేజీ నిష్పత్తితో పోలిస్తే పెద్దదిగా ఉన్నందున సంపాదకులు ప్రచురించడానికి ఇష్టపడరు. అదే విధంగా సీబోర్గ్ ప్రవేశపెట్టిన ఆధునిక రూపంతో రసాయన శాస్త్రవేత్తల పరిచయం ఎక్కువగా ఉంది.[84]
వివిధ నిర్మాణాలతో పట్టికలు
మార్చు1869 లో మెండలీవ్ యొక్క పట్టిక కనుగొన్నప్పటి నుండి 100 సంవత్సరాలలో, ఆవర్తన పట్టికను 700 రకాల వేర్వేరు రూపాలలో ప్రచురించిన సంస్కరణలను ఎడ్వర్డ్ జి. మజుర్స్ సేకరించాడు.[83][85][86] అనేక దీర్ఘచతురస్రాకార వైవిధ్యాలతో పాటు, ఇతర ఆవర్తన పట్టిక ఆకృతులు ఆకారంలో ఉన్నాయి. ఉదాహరణకు, ఒక వృత్తం, ఘనం, స్థూపం, భవనం, సర్పిలాకారం, లెమ్నిస్కేట్,[87] అష్టభుజి పట్టకం, పిరమిడ్, గోళం, త్రిభుజం వంటి రూపాలలో కూడా రూపొందించారు[n 8]. సాంప్రదాయ ఆవర్తన పట్టికలలో అంత స్పష్టంగా కనిపించని మూలకాల యొక్క రసాయన లేదా భౌతిక లక్షణాలను హైలైట్ చేయడానికి లేదా నొక్కిచెప్పడానికి ఇటువంటి ప్రత్యామ్నాయాలు తరచుగా అభివృద్ధి చేయబడతాయి.[86]
ప్రత్యామ్నాయ నిర్మాణాలలో ఒట్టో థియోడోర్ బెన్ఫే (1960) ముఖ్యమైనది.[88] మూలకాలు అవిచ్ఛిన్నంగా సర్పిలాకారంలో ఉండి హైడ్రోజన్ మధ్య భాగంలో ఉంటుంది. లోహాలు, లాంథనైడ్లు, ఆక్టినైడ్లు ద్వీపకల్ప ఆకారాలలో అమర్చబడి ఉంటాయి.[89]
చాలా ఆవర్తన పట్టికలు ద్విమితీయమైనవి;[6] త్రిమితీయ పట్టికలు 1862 నాటికి తెలిసినవి (1969లో మెండలీవ్ ద్విమితీయ ఆవర్తన పట్టిక కంటే ముందు) . ఇటీవలి ఉదాహరణలున్న [90] కోర్టీన్ ఆవర్తన వర్గీకరణం (1925), గెగురే ఆవర్గన సర్పిలము 1965),[91] డూపర్స్ ఆవర్తన వృక్షం [92] కూడా ఉండేవి. స్టోవ్ తయారుచేసిన భౌతిక శాస్త్రవేత్తల ఆవర్తన పట్టిక (1989)[93] చతుర్థ మితీయంగా ఉండేది.[94]
భౌతిక-రసాయన శాస్త్ర రంగాల శ్రేణిలో వివిధ ఆవర్తన పట్టిక రూపాలు ఉన్నాయి.[95] శ్రేణిలో రసాయన శాస్త్ర చివరి వైపు రైనర్-కాన్హాం తయారుచేసిన "నియమ విరుద్ధ" అకర్బన రసాయన శాస్త్రవేత్తల ఆవర్తన పట్టిక (2002), ఇది రసాయన మూలకాల పోకడలు, నమూనాలను, అసాధారణ రసాయన సంబంధాలు, లక్షణాలను నొక్కి చెబుతుంది.
శ్రేణిలో భౌతిక శాస్త్ర చివరి వైపు జానెట్ తయారుచేసిన లెఫ్ట్-సైడ్ ఆవర్తన పట్టిక (1928) ఉంది. ఇది ఎలక్ట్రాన్-కక్ష్యలలో చేరే క్రమం, క్వాంటం మెకానిక్స్ దగ్గరి సంబంధాన్ని చూపించే ఒక నిర్మాణాన్ని కలిగి ఉంది.[96] కొంతవరకు ఇలాంటి విధానాన్ని ఆల్పెర్ తీసుకున్నాడు.[97] అయినప్పటికీ రసాయన, భౌతిక ఆవర్తనాలను ప్రదర్శించవలసిన అవసరాన్ని విస్మరించారని ఎరిక్ సెర్రి చే విమర్శించబడ్డాడు.[98] ఆ ఆవర్తన పట్టికల శ్రేణి మధ్యలో ఎక్కడో ఆవర్తన పట్టిక యొక్క సర్వవ్యాప్త సాధారణ లేదా ప్రామాణిక రూపం ఉంది. ఇది భౌతిక స్థితి, విద్యుత్, ఉష్ణ వాహకత, ఆక్సీకరణ సంఖ్యలు, రసాయన ప్రయోగశాలను సాంప్రదాయ పద్ధతుల ద్వారా సులభంగా నిర్వహించిన ఇతర లక్షణాలలో అనుభావిక పోకడలను కలిగి మెరుగ్గా వ్యక్తీకరిస్తుంది.[99] ఈ లేఅవుట్ నిర్మాణం, పరిమాణం యొక్క సౌలభ్యం పరంగా మంచి సమతుల్యతను కలిగి ఉండటం, పరమాణు క్రమం, ఆవర్తన పోకడల యొక్క వర్ణన ఫలితంగా దీని ప్రజాదరణ ఉంటుంది.[100][101]
బహిరంగ ప్రశ్నలు, వివాదాలు
మార్చుహైడ్రోజన్, హీలియం యొక్క స్థానం
మార్చుఎలక్ట్రాన్ విన్యాసం పరంగా హైడ్రోజన్ (ఎలక్ట్రానిక్ విన్యాసం 1s1), హీలియం (1s2) లు ఆవర్తన పట్టికలో 1, 2 గ్రూపులలో ఉండాలి. ఈ రెండు మూలకాలు లిథియం (1s22s1), బెరెలియం (1s22s2) మూలకాలకు పైన అమరి ఉండాలి.[20] హైడ్రోజన్కు అటువంటి స్థానం సాధారణం అయితే, ఎలక్ట్రాన్ నిన్యాసాన్ని ఆధారంగా చేసుకుని హీలియం ఆ స్థానంలో లేదు. 1900లలో ఉత్కృష్ట వాయువులు (జడ వాయువులు) కనుగొనబడి, "గ్రూపు 0"లో చేర్చబడినవి. ఈ మూలకాలు జడవాయువులుగా ఎటువంటి రసాయన చర్యాశీలత ప్రదర్శించనదున ఈ మూలకాలకు సంబంధించిన గ్రూపులో పై భాగంలో హీలియాన్ని కూడా చేర్చారు. జడవాయువుల గ్రూపుకు అధికారిక సంఖ్యను మార్చడంతో, చాలా మంది శాస్త్రవేత్తలు 18 వ గ్రూపులో, నియాన్ పైన నేరుగా హీలియాన్ని కేటాయించడం కొనసాగించారు; ప్రస్తుతం ఉన్న IUPAC పట్టికలో హీలియం మూలకాన్ని నియాన్ పైన కొససాగించడం జరిగింది.[102]
గ్రూఫు 1 లో హైడ్రోజన్ స్థానం సహేతుకంగా బాగా స్థిరపడుతుంది. దీని ఆక్సీకరణ స్థితి +1. ఆ గ్రూపులో ఉన్న క్షారలోహాల ఆక్సీకరణ స్థితి కూడా +1. లిథియం మాదిరిగా, ఇది గణనీయమైన సమయోజనీయ ధర్మాలను కలిగి ఉంది.[103][104] ఇది క్షారలోహాల నిర్మాణాల మాదిరిగా ఆ గ్రూపులో ఉండగలదు.[105] ఇది పరివర్తన మూలకాలతో కలసి హైడ్రైడ్ వంటి మిశ్రమలోహాలను, లోహ బంధాలను ఏర్పరిచే సామర్థ్యం కలిగి ఉంది.[106] ఏదేమైనా, ఇది కొన్నిసార్లు వేరే చోట ఉంచబడుతుంది. ఇది కచ్చితమైన ఏక సంయోజనీయ పదార్థం, అలోహం అయినందున 17వ[98] గ్రూపులో పైన ఉంచబడే ప్రత్యామ్నాయం కూడా ఉంది. ఇది అలోహం, ఏక సంయోజకత గల ఫ్లోరిన్ పై భాగంలో ఉండాలి. కొన్నిసార్లు, హైడ్రోజన్ క్షార లోహాలు, హాలోజెన్ రెండింటికి అనుగుణమైన లక్షణాలను కలిగి ఉందని చూపించడానికి, ఇది రెండు గ్రూపులలో పైభాగంలో ఒకేసారి చూపబడుతుంది.[107]
మరొక సూచన ప్రకారం గ్రూపు 14 లో కార్బన్ పైన హైడ్రోజన్ ఉంది: ఆ విధంగా ఉంచినప్పుడు, ఇది అయనీకరణ శక్మము విలువలు, ఎలక్ట్రాన్ ఎఫినిటీ విలువలను పెంచే పోకడలకు బాగా సరిపోతుంది, హైడ్రోజన్ గ్రూపు 14 మూలకాల మాదిరిగా చతుర్థ సంయోజక లక్షణాన్ని చూపించలేనప్పటికీ, ఋణవిద్యుదాత్మకత ధోరణికి దూరంగా లేదు.[108] చివరగా, హైడ్రోజన్ కొన్నిసార్లు ఏదైనా గ్రూపు నుండి విడిగా ఉంచబడుతుంది; ఇది దాని సాధారణ లక్షణాలపై ఆధారపడి ఉంటుంది, ఇది ఇతర గ్రూపులలోణి మూలకాల నుండి భిన్నంగా ఉంటుంది.
పీరియడ్ 1 లోని ఇతర మూలకం హీలియం, అప్పుడప్పుడు ఏదైనా గ్రూపు నుంచి వేరుగా ఉంచబడుతుంది.[109]
మిగిలిన జడ వాయువుల నుండి హీలియాన్ని వేరుచేసే లక్షణం ఏమిటంటే, దాని బాహ్య ఎలక్ట్రాన్ కక్ష్యలో రెండు ఎలక్ట్రాన్లు మాత్రమే కలిగి ఉంటుంది, మిగిలిన నోబెల్ వాయువులు ఎనిమిది ఎలక్ట్రాన్లు కలిగి ఉంటాయి.[110]
6,7 పీరియడ్లలో గ్రూపు-3 మూలకాలు
మార్చుగ్రూపు 3 లోని స్కాండియం, యట్రియం ఎల్లప్పుడూ మొదటి రెండు మూలకాలుగా ఉన్నప్పటికీ, తరువాతి రెండు మూలకాల స్థానం గుర్తింపు పూర్తిగా పరిష్కారం కాలేదు. సాధారణంగా అవి లాంథనం, ఆక్టీనియం అవుతాయి. కొన్ని సార్లు అవి లుటేషియం, లారెన్షియంగా కూడా తీసుకుంటారు. ఈ రెండు వైవిధ్యాలు ఆవర్తన పట్టికలో లాంథనైడ్లను ఉంచడంలో చారిత్రక ఇబ్బందులు ఏర్పడ్డాయి. f- బ్లాకు మూలకాలు ఎక్కడ ప్రారంభమవుతాయో, ఎక్కడ అంతమవుతాయో అనే విషయంలో సందిగ్దత ఏర్పడింది.[111][n 9][n 10] "[ఆవర్తన] వ్యవస్థను తీవ్రంగా ఉల్లంఘించి బ్లాక్లుగా విభజించడం పొరపాటు" అనే వాదనలు దీనికి రుజువు అని పేర్కొన్నారు.[113] ముడవ భిన్నమైన వాదన ప్రకారం యిట్రియం మూలకం క్రింది రెండు స్థానాలలో లాంథనైడ్లు, ఆక్టినైడ్లు ఆక్రమిస్తాయి. నాల్గవ భిన్నమైన వాదన ప్రకారం మూడవ గ్రూపు Sc-Y తరువాత, La-Ac శాఖ, Lu-Lr శాఖగా విభజిస్తుంది.[114]
రసాయన, భౌతిక ధర్మాల వాదనలు లుటీషియం, లారెన్షియం[115][116]కు మద్దతుగా చేయబడ్డాయి. కాని ఎక్కువ మంది శాస్త్రవేత్తలు అంగీకరించలేదు.[117] చాలా మంది రసాయన శాస్త్రవేత్తలకు ఏ విధమైన వివాదం ఉందని తెలియదు.[118] ఈ విషయంపై సిఫారసు చేయడానికి 2015 డిసెంబరులో IUPAC ప్రాజెక్టును ఏర్పాటు చేశారు.[119]
లాంథనం, ఆక్టీనియం
మార్చుLa and Ac below Y |
లాంథనం, ఆక్టీనియం సాధారణంగా గ్రూపు 3 మూలకాలుగా వివరించబడ్డాయి[120][n 11]. మూలకాల ఎలక్ట్రాన్ విన్యాసాలపై ఆధారపడే ఆవర్తన పట్టికలు మూలకాలలో భేదపరిచే ఎలక్ట్రాన్ చేరే భావనతో ఏర్పడిన లే అవుట్ 1940 లలో ఉద్భవించింది. సీసియం, బేరియం మూలకాల ఎలక్ట్రాన్ విన్యాసాలు వరుసగా [Xe]6s1, [Xe]6s2, [Xe]5d16s2. లాంథనంలో బేధపరిచే ఎలక్ట్రాన్ 5d ఆర్బిటాల్ లో చేరుతుంది. లాంథనం "మూడవ గ్రూపులో మొదటి మూలకంగా, ఆరవ పీరియడ్ లో మొదటి మూలకంగా ఉంచబడింది."[121] గ్రూపు 3 లో ఉన్న వరుస మూలకాల ఎలక్ట్రాన్ విన్యాసాలు: స్కాండియం [Ar]3d14s2, యిట్రియం [Kr]4d15s2, లాంథనం [Xe]5d16s2. 6వ పీరియడ్ లో యిటెర్బియం ఎలక్ట్రాన్ విన్యాసం [Xe]4f135d16s2, లుటేషియం ఎలక్ట్రాన్ విన్యాసం [Xe]4f145d16s2,కలిగి ఉన్నాయి. ఫలితంగా లుటీషియంలో భేదపరిచే ఎలక్ట్రాన్ 4f లో చేరి, అది 6వ పీరియడ్ లో ఎఫ్-బ్లాక్ చివరి మూలకంగా స్థిరపడుతుంది.[121]
ఎలక్ట్రాన్ వర్ణపట మాపనం ఆధారంగా యిటెర్బియం ఎలక్ట్రాన్ విన్యాసం [Xe]4f146s2 అని కనుగొనబడింది. అనగా యిటెర్బియం, లుటేషియం మూలకాలు [Xe]4f145d16s2 తర్వాత ఉండి రెండూ 14 f- ఎలక్ట్రాన్లను కలిగి ఉంటాయి. "ఫలితంగా f-భేదపరిచే ఎలక్త్రాన్ కాకుండా d- వస్తుంది". అందువలన లుటీషియం,లాంథనం [Xe]5d16s2 వలె సమాన ధర్మాలను కలిగి ఉంతుంది. ఇది గ్రూపు 3 లో యిట్రియం దిగువన అమరి ఉంటుంది.[121] 5d1 ఎలక్ట్రాన్ విన్యాసం మొదటిసారి లాంథనంలో ఉన్నందున ప్రయోజనాన్ని కలిగి ఉంది. అయితే ఈ నిర్మాణం ఇది మూడవసారి లుటిషియంలో కనిపిస్తుంది, గాడోలినియంలో క్లుప్తంగా రెండవసారి కనిపించింది.[122] రసాయన ప్రవర్తన[123] పరంగా, గ్రూపు 3 మూలకాలలో పై నుండి క్రిందికి వచ్చే కోలదీ స్కాండియం, యట్రియం, లాంథనం, ఆక్టినియం మూలకాలకు ఉండే ద్రవీభవన స్థానం, ఎలక్ట్రోనెగటివిటీ, అయానిక వ్యాసార్థం[124][125] వంటి లక్షణాలు 1-2 గ్రూపుల మూలకాలతో సమస్థాయిలో ఉన్నాయి. ఎఫ్ బ్లాకు మూలకాల సాధారణ (త్రిసంయోజకత) అయాన్ల లోని ఎఫ్-ఎలక్ట్రాన్ల సంఖ్య ఆ మూలకాలు ఎఫ్-బ్లాకులో స్థానం ఉండేటట్లు ఉంది.[126] ఉదాహరణకు త్రిసంయోజక అయాన్ల యొక్క మొదటి మూడు ఎఫ్-ఎలక్ట్రాన్ల సంఖ్య Ce 1, Pr 2, Nd 3.[127]
లుటేషియం, లారెన్షియం
మార్చుఇతర పట్టికలలో లుటీషియం, లారెన్షియం మూలకాలు గ్రూపు - 3 లో ఉంటాయి[n 12]. స్కాండియం, యట్రియం, లుటిషియంలను రసాయనికంగా వేరు చేయడానికి ఉన్న ప్రారంభ పద్ధతులు ఈ మూలకాలు కలసి "యిట్రియం గ్రూపు" పిలువబడే వర్గానికి చెందుతాయని తెలుస్తుంది. అదే విధంగా "సీరియం గ్రూఫు"లో లాంథనం, ఆక్టీనియం ఉంటాయి.[121] దీని ప్రకారం, "లాంథనం"ను కాకుండా లుటిషియంను 1920, 30 లలో కొంతమంది రసాయన శాస్త్రవేత్తలు గ్రూప్ 3 కి కేటాయించారు.[n 13]
Lu and Lr below Y |
1950, 60 లలో చాలా మంది భౌతిక శాస్త్రవేత్తలు దాని భౌతిక లక్షణాలను లాంథనం పోలికలతో పోల్చి చూసి, లుటెటియం గ్రూపు 3 లో ఉండుటను ఆదరించారు.[121] లాంథనంలో ఎఫ్-ఎలక్ట్రాన్లు లేనందున లాంథనాన్ని ఎఫ్-బ్లాకు మూలకాలలో మొదటి మూలకంగా ఉంచటాన్ని కొంతమంది శాస్త్రవేత్తలు వివాదాస్పదంగా ఉన్నారు. ఇది ఇతర అవర్తన పట్టికలలోక్రమ రాహిత్యంగా ఉందని వాదించారు. ఉదాహరణకు ఎటువంటి ఎఫ్-ఎలక్ట్రాన్లు లేనప్పటికీ థోరియం ఎఫ్-బ్లాకులో ఉంది.[128]
లారెన్షియం విషయానికొస్తే, దాని వాయు స్థితి పరమాణు ఎలక్ట్రాన్ విన్యాసం [Rn]5f147s27p1గా 2015 లో నిర్ధారించబడింది. లారెన్షియం ఎఫ్-బ్లాక్, డి-బ్లాక్లో ఉందా అనే దానితో సంబంధం లేకుండా ఇటువంటి విన్యాసం మరొక ఆవర్తన పట్టిక క్రమరాహిత్యాన్ని సూచిస్తుంది. ఎందుకంటే [Rn]5f146d107s27p1 ఊహించిన ఎలక్ట్రాన్ విన్యాసం ప్రకారం నిహోనియం ము పి-బ్లాకు మూలకంగా ఉంచవచ్చు[129][n 14]. రసాయనికంగా స్కాండియం, యిట్రియం, లుటీషియం (, హుశా లారెన్షియాలు గ్రూపు 1,2 లోహాల వలె త్రిసంయోజకత కలిగి ఉంటాయి.[131] వాటి గ్రూపులోని మూలకాల ద్రవీభవన స్థానం, ఎలెక్ట్రోనెగటివిటీ, అయానిక్ వ్యాసార్థం వంటి లక్షణాలు, గ్రూపు 4–8 ప్రతిరూపాలలో కనిపించే మాదిరిగానే ఉంటాయి.[121] ఎఫ్-బ్లాకు మూలకాల వాయుస్థితిలోని ఎఫ్-ఎలక్ట్రాన్ల సంఖ్య అవి ఎఫ్-బ్లాకులో ఉండే విధంగా సరిపోతాయి. ఉదాహరణకు ఎఫ్-బ్లాకు మూలకాల మొదటి ఐదు ఎఫ్-ఎలక్ట్రాన్ల సంఖ్యలు La 0, Ce 1, Pr 3, Nd 4, Pm 5.[121]
లాంథనైడ్లు, ఆక్టినైడ్లు
మార్చుMarkers below Y |
కొంతమంది రచయితలు లాంథనైడ్లు, ఆక్టినైడ్లుగా ఉన్న 30 మూలకాలు యిట్రియం క్రింద రెండు స్థానాలలో ఉంచారు. 2005 నాటికి రెడ్ బుక్లో, IUPAC- అంగీకరించిన సంస్కరణగా పేర్కొన్న (తరువాతి చాలా సంస్కరణలు ఉన్నాయి, చివరి నవీకరణ 2018 డిసెంబరు 1 నుండి జరిగింది)[132][n 15] వివరాలను బట్టి 15 లాంథనైడ్లు మూలకాలు (La–Lu) సారూప్యతను కలిగి ఉన్నట్లు, యిట్రియం క్రిందన రెండు గ్రూపులలో మూడు స్థానాలను ఆక్రమించాయని, 15 నిలువు వరుసలు గల ఎఫ్-బ్లాకు అని అస్పష్టంగా తెలియజేయబడింది[n 16].
La-Ac, Lu-Lr
మార్చుగ్రూపు -3 మూలకాలు Sc-Y తరువాత La-Ac శాఖ, Lu-Lr శాఖలుగా వర్గీకరించారు. రసాయన, భౌతిక సమాచారం ఆధారంగా Sc-Y-La-Ac లేదా Sc-Y-Lu-Lr కు అనుకూల వాదనలు అసంపూర్తిగా ఉన్నాయి.[134] గుర్తించిన సమాచారం ఆధారంగా, 1−2 గ్రూపులలో[135] Sc-Y-La-Ac సారూప్య పోకడలు తగ్గుతాయి, అయితే Sc-Y-Lu-Lr 4−10[121] గ్రూపులలో మెరుగైన సారూప్య పోకడలు ఉన్నాయి. .
పరివర్తన మూలకాలలో చేర్చబడిన గ్రూపులు
మార్చుIUPAC తెలియజేసిన నిర్వచనం ఆధారంగా "పరివర్తన మూలకాలు" అనగా వాటిలో సంపూర్ణంగా నిండిన డి-ఉప కక్ష్యలు ఉంటాయి.[136] ఈ నిర్వచనం ప్రకారం 3 నుండి 11 గ్రూఫులలో ఉన్న అన్ని మూలకాలు పరివర్తన మూలకాలు అవుతాయి. IUPAC నిర్వచనం ప్రకారం జింకు, కాడ్మియం, పాదరసం మూలకాలుగా గల 12వ గ్రూపును పరివర్తన మూలకాలనుండి వేరుచేసారు. కొంతమంది రసాయన శాస్త్రవేత్తలు "డి-బ్లాక్ మూలకాలు", "పరివర్తన లోహాలు" అనే వర్గాలను పరస్పరం మార్చుతుంటారు. తద్వారా పరివర్తన లోహాలలో 3–12 గ్రూపులతో సహా ఉన్నట్లు భావిస్తారు. ఈ సందర్భంలో, గ్రూపు 12 మూలకాలను పరివర్తన లోహాల ప్రత్యేక సందర్భంగా పరిగణిస్తారు, దీనిలో d ఎలక్ట్రాన్లు సాధారణంగా రసాయన బంధంలో పాల్గొనవు. 2007లో ఒక నివేదిక ప్రకారం మెర్క్యురీ ఫ్లోరైడ్ (HgF4) అనే సమ్మేళనము దానిలోని రసాయన బంధం కోసం డి-ఎలక్ట్రాన్లను వినియోగించుకుంది. ఈ విషయం పాదరసం పరివర్తన లోహంగా పరిగణించబడుతుందని సూచించడానికి కొంతమంది వ్యాఖ్యాతలను ప్రేరేపించింది.[137] జెన్సెన్[138] వంటి ఇతర వ్యాఖ్యాతలు, HgF4 వంటి సమ్మేళనం ఏర్పడటం చాలా అసాధారణ పరిస్థితులలో మాత్రమే సంభవిస్తుందని వాదించారు; నిజానికి, దాని ఉనికి ప్రస్తుతం వివాదాస్పదంగా ఉంది. అందువల్ల, ఈ పదానికి సాధారణ అర్ధానికి గల సహేతుకమైన వ్యాఖ్యానం ద్వారా పాదరసం పరివర్తన లోహంగా పరిగణించబడదు.[138]
ఇంకా ఇతర రసాయన శాస్త్రవేత్తలు గ్రూప్ 3 మూలకాలను పరివర్తన లోహం నిర్వచనం నుండి మినహాయించారు. గ్రూపు 3 మూలకాలు పాక్షికంగా ఆక్రమించిన డి-ఉపస్థాయిని కలిగి ఉన్న అయాన్లను ఏర్పరచవు. అందువల్ల పరివర్తన లోహ రసాయన ధర్మాలను కలిగి ఉండవు.[139] ఈ సందర్భంలో, 4–11 గ్రూపులు మాత్రమే పరివర్తన లోహాలుగా పరిగణించబడతాయి. అయినప్పటికీ గ్రూపు 3 మూలకాలు పరివర్తన లోహాల కొన్ని రసాయన ధర్మాలను, కొన్ని భౌతిక ధర్మాలను కూడా చూపుతాయి.[140]
తెలియని రసాయన లక్షణాలతో మూలకాలు
మార్చుఒగనేసన్ వరకు ఉన్న అన్ని మూలకాలు కనుగొనబడినప్పటికీ, హాసియం (మూలకం 108) పైన ఉన్న మూలకాలలో, కోపర్నిసియం (మూలకం 112), నిహోనియం, (మూలకం 113), ఫ్లెరోవియం (మూలకం 114) మాత్రమే తెలిసిన రసాయన లక్షణాలను కలిగి ఉన్నాయి. కోపర్నిసియం మాత్రమే ప్రస్తుతం నిశ్చయాత్మక వర్గీకరణకు తగిన సాక్ష్యంగా ఉంది. సాపేక్ష ప్రభావాల వల్ల ఇతర మూలకాలు అతినిక్షేపము ద్వారా ఊహించిన దానికంటే భిన్నంగా ప్రవర్తిస్తాయి; ఉదాహరణకు, ఫ్లెరోవియం ప్రస్తుతం కార్బన్ గ్రూపులో ఉంచబడినప్పటికీ, కొన్ని జడవాయువు లాంటి లక్షణాలను ప్రదర్శిస్తుందని అంచనా వేయబడింది.[141] ప్రస్తుత ప్రయోగాత్మక సాక్ష్యాలు ఫ్లెరోవియం ఒక లోహం లేదా జడవాయువు లాగా ప్రవర్తిస్తుందా అనే ప్రశ్నను ఇప్పటికీ సమస్యగానే ఉంది.[142]
ఇతరములు
మార్చుఆవర్తన పట్టిక 150 వ వార్షికోత్సవాన్ని పురస్కరించుకుని, ఐక్యరాజ్యసమితి 2019 సంవత్సరాన్ని అంతర్జాతీయ ఆవర్తన పట్టిక సంవత్సరంగా ప్రకటించింది, "విజ్ఞాన శాస్త్రంలో అత్యంత ముఖ్యమైన విజయాలలో ఒకటి" అని ఉత్సవాలు జరుపుకుంది.[143]
నోట్సు
మార్చు- ↑ కృత్రిమంగా తయారుచేయబడిన తర్వాత ప్రకృతిలో లభించినవి. అవి టెక్నీషియం (Z=43), ప్రోమేథియం (61), ఆస్టాటిన్ (85), ఫ్రాన్షియం (87),నెప్ట్యూన్యం (93), ప్లూటోనియం (94), అమెరిసియం (95), క్యూరియం (96),బెర్కెలియం (97), కాలిఫోర్నియం (98).
- ↑ Some tables include an element zero (i.e. a substance composed purely of neutrons), although this is uncommon. See, for example. Philip Stewart's Chemical Galaxy.
- ↑ There is an inconsistency and some irregularities in this convention. Thus, helium is shown in the p-block but is actually an s-block element, and (for example) the d-subshell in the d-block is actually filled by the time group 11 is reached, rather than group 12.
- ↑ The noble gases, astatine, francium, and all elements heavier than americium were left out as there is no data for them.
- ↑ While fluorine is the most electronegative of the elements under the Pauling scale, neon is the most electronegative element under other scales, such as the Allen scale.
- ↑ An antecedent of Deming's 18-column table may be seen in Adams' 16-column Periodic Table of 1911. Adams omits the rare earths and the "radioactive elements" (i.e. the actinides) from the main body of his table and instead shows them as being "careted in only to save space" (rare earths between Ba and eka-Yt; radioactive elements between eka-Te and eka-I). See: Elliot Q. A. (1911). "A modification of the periodic table". Journal of the American Chemical Society. 33(5): 684–688 (687).
- ↑ A second extra-long periodic table row, to accommodate known and undiscovered elements with an atomic weight greater than bismuth (thorium, protactinium and uranium, for example), had been postulated as far back as 1892. Most investigators considered that these elements were analogues of the third series transition elements, hafnium, tantalum and tungsten. The existence of a second inner transition series, in the form of the actinides, was not accepted until similarities with the electron structures of the lanthanides had been established. See: van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. p. 315–316, ISBN 0-444-40776-6.
- ↑ See The Internet database of periodic tables for depictions of these kinds of variants.
- ↑ But for the existence of the lanthanides the composition of group 3 would not have been a source of any special interest, since scandium, yttrium, lanthanum and actinium exhibit the same gradual change in properties as do calcium, strontium, barium and radium in group 2.[112]
- ↑ The detachment of the lanthanides from the main body of the periodic table has been attributed to the Czech chemist Bohuslav Brauner who, in 1902, allocated all of them ("Ce etc.") to one position in group 4, below zirconium. This arrangement was referred to as the "asteroid hypothesis", in analogy to asteroids occupying a single orbit in the solar system. Before this time the lanthanides were generally (and unsuccessfully) placed throughout groups I to VIII of the older 8-column form of periodic table. Although predecessors of Brauner's 1902 arrangement are recorded from as early as 1895, he is known to have referred to the "chemistry of asteroids" in an 1881 letter to Mendeleev. Other authors assigned all of the lanthanides to either group 3, groups 3 and 4, or groups 2, 3 and 4. In 1922 Niels Bohr continued the detachment process by locating the lanthanides between the s- and d-blocks. In 1949 Glenn T. Seaborg (re)introduced the form of periodic table that is popular today, in which the lanthanides and actinides appear as footnotes. Seaborg first published his table in a classified report dated 1944. It was published again by him in 1945 in Chemical and Engineering News, and in the years up to 1949 several authors commented on, and generally agreed with, Seaborg's proposal. In that year he noted that the best method for presenting the actinides seemed to be by positioning them below, and as analogues of, the lanthanides. See: Thyssen P. and Binnemans K. (2011). "Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis". In K. A. Gschneider Jr. (ed). Handbook on the Physics and Chemistry of the Rare Earths. 41. Amsterdam: Elsevier, pp. 1–94; Seaborg G. T. (1994). Origin of the Actinide Concept'. In K. A. Gschneider Jr. (ed). Handbook on the Physics and Chemistry of the Rare Earths. 18. Amsterdam: Elsevier, pp. 1–27.
- ↑ For examples of this table see Atkins et al. (2006). Shriver & Atkins Inorganic Chemistry (4th ed.). Oxford: Oxford University Press • Myers et al. (2004). Holt Chemistry. Orlando: Holt, Rinehart & Winston • Chang R. (2000). Essential Chemistry (2nd ed.). Boston: McGraw-Hill
- ↑ For examples of the group 3 = Sc-Y-Lu-Lr table see Rayner-Canham G. & Overton T. (2013). Descriptive Inorganic Chemistry (6th ed.). New York: W. H. Freeman and Company • Brown et al. (2009). Chemistry: The Central Science (11th ed.). Upper Saddle River, New Jersey: Pearson Education • Moore et al. (1978). Chemistry. Tokyo: McGraw-Hill Kogakusha
- ↑ The phenomenon of different separation groups is caused by increasing basicity with increasing radius, and does not constitute a fundamental reason to show Lu, rather than La, below Y. Thus, among the Group 2 alkaline earth metals, Mg (less basic) belongs in the "soluble group" and Ca, Sr and Ba (more basic) occur in the "ammonium carbonate group". Nevertheless, Mg, Ca, Sr and Ba are routinely collocated in Group 2 of the periodic table. See: Moeller et al. (1989). Chemistry with Inorganic Qualitative Analysis (3rd ed.). SanDiego: Harcourt Brace Jovanovich, pp. 955–956, 958.
- ↑ Even if metallic lawrencium has a p electron, simple modelling studies suggest it will behave like a lanthanide,[130] as do the rest of the late actinides.[127]
- ↑ Notwithstanding, an IUPAC member subsequently wrote that, "IUPAC has not approved any specific form of the periodic table, and an IUPAC-approved form does not exist, though even members of IUPAC themselves have published diagrams titled “IUPAC Periodic Table of the Elements". However, the only specific recommendation IUPAC has made concerning the periodic table covers the Group numbering of 1–18."[133]
- ↑ For examples of the group 3 = Ln and An table see Housecroft C. E. & Sharpe A. G. (2008). Inorganic Chemistry (3rd ed.). Harlow: Pearson Education • Halliday et al. (2005). Fundamentals of Physics (7th ed.). Hoboken, NewJersey: John Wiley & Sons • Nebergall et al. (1980). General Chemistry (6th ed.). Lexington: D. C. Heath and Company
మూలాలు
మార్చు- ↑ Meija, Juris; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". Pure and Applied Chemistry. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ↑ Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". Pure and Applied Chemistry. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ↑ Greenwood, pp. 24–27
- ↑ Gray, p. 6
- ↑ Koppenol, W. H. (2002). "Naming of New Elements (IUPAC Recommendations 2002)" (PDF). Pure and Applied Chemistry. 74 (5): 787–791. doi:10.1351/pac200274050787.
- ↑ 6.0 6.1 6.2 Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New ed.). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ↑ Haire, Richard G. (2006). "Fermium, Mendelevium, Nobelium and Lawrencium". In Morss; Edelstein, Norman M.; Fuger, Jean (eds.). The Chemistry of the Actinide and Transactinide Elements (3rd ed.). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 1-4020-3555-1.
{{cite book}}: CS1 maint: ref duplicates default (link) - ↑ Scerri 2007, p. 24
- ↑ Messler, R. W. (2010). The essence of materials for engineers. Sudbury, MA: Jones & Bartlett Publishers. p. 32. ISBN 0763778338.
- ↑ Bagnall, K. W. (1967). "Recent advances in actinide and lanthanide chemistry". In Fields, PR; Moeller, T (eds.). Advances in chemistry, Lanthanide/Actinide chemistry. Advances in Chemistry. Vol. 71. American Chemical Society. pp. 1–12. doi:10.1021/ba-1967-0071. ISBN 0-8412-0072-6
{{cite book}}: CS1 maint: postscript (link) - ↑ Day, M. C.; Selbin, J. (1969). Theoretical inorganic chemistry (2nd ed.). New York, MA: Reinhold Book Corporation. p. 103. ISBN 0763778338.
- ↑ Holman, J.; Hill, G. C. (2000). Chemistry in context (5th ed.). Walton-on-Thames: Nelson Thornes. p. 40. ISBN 0174482760.
- ↑ 13.0 13.1 Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990. Blackwell Science. ISBN 0-632-02494-1.
- ↑ Fluck, E. (1988). "New Notations in the Periodic Table" (PDF). Pure Appl. Chem. 60 (3). IUPAC: 431–436. doi:10.1351/pac198860030431. Retrieved 24 March 2012.
- ↑ 15.0 15.1 Moore, p. 111
- ↑ 16.0 16.1 16.2 Greenwood, p. 30
- ↑ Stoker, Stephen H. (2007). General, organic, and biological chemistry. New York: Houghton Mifflin. p. 68. ISBN 978-0-618-73063-6. OCLC 52445586.
- ↑ Mascetta, Joseph (2003). Chemistry The Easy Way (4th ed.). New York: Hauppauge. p. 50. ISBN 978-0-7641-1978-1. OCLC 52047235.
- ↑ Kotz, John; Treichel, Paul; Townsend, John (2009). Chemistry and Chemical Reactivity, Volume 2 (7th ed.). Belmont: Thomson Brooks/Cole. p. 324. ISBN 978-0-495-38712-1. OCLC 220756597.
- ↑ 20.0 20.1 Gray, p. 12
- ↑ Jones, Chris (2002). d- and f-block chemistry. New York: J. Wiley & Sons. p. 2. ISBN 978-0-471-22476-1. OCLC 300468713.
- ↑ Silberberg, M. S. (2006). Chemistry: The molecular nature of matter and change (4th ed.). New York: McGraw-Hill. p. 536. ISBN 0071116583.
- ↑ Manson, S. S.; Halford, G. R. (2006). Fatigue and durability of structural materials. Materials Park, Ohio: ASM International. p. 376. ISBN 0871708256.
- ↑ Bullinger, Hans-Jörg (2009). Technology guide: Principles, applications, trends. Berlin: Springer-Verlag. p. 8. ISBN 9783540885450.
- ↑ Gray, p. 11
- ↑ Jespersen, N. D. (2010). Barron's AP chemistry (5 revised ed.). Hauppauge, NY: Barron's Educational Series. p. 117. ISBN 0764140507.
- ↑ 27.0 27.1 Myers, R. (2003). The basics of chemistry. Westport, CT: Greenwood Publishing Group. pp. 61–67. ISBN 0313316643.
- ↑ 28.0 28.1 Chang, Raymond (2002). Chemistry (7 ed.). New York: McGraw-Hill. pp. 289–310, 340–42. ISBN 0-07-112072-6.
- ↑ Greenwood, p. 27
- ↑ 30.0 30.1 Jolly, W. L. (1991). Modern Inorganic Chemistry (2nd ed.). McGraw-Hill. p. 22. ISBN 978-0-07-112651-9.
- ↑ 31.0 31.1 31.2 Greenwood, p. 28
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Electronegativity".
- ↑ Pauling, L. (1932). "The Nature of the Chemical Bond. IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms". Journal of the American Chemical Society. 54 (9): 3570–3582. doi:10.1021/ja01348a011.
- ↑ Huheey, Keiter & Keiter, p. 42
- ↑ Siekierski, Slawomir; Burgess, John (2002). Concise chemistry of the elements. Chichester: Horwood Publishing. pp. 35‒36. ISBN 1898563713.
- ↑ 36.0 36.1 Chang, pp. 307–309
- ↑ Huheey, Keiter & Keiter, pp. 42, 880–81
- ↑ Yoder, C. H.; Suydam, F. H.; Snavely, F. A. (1975). Chemistry (2nd ed.). Harcourt Brace Jovanovich. p. 58. ISBN 0-15-506465-7.
- ↑ Huheey, Keiter & Keiter, pp. 880–85
- ↑ Sacks, O (2009). Uncle Tungsten: Memories of a chemical boyhood. New York: Alfred A. Knopf. pp. 191, 194. ISBN 0-375-70404-3.
- ↑ Gray, p. 9
- ↑ Siegfried, Robert (2002). From elements to atoms: a history of chemical composition. Philadelphia, Pennsylvania: Library of Congress Cataloging-in-Publication Data. p. 92. ISBN 0-87169-924-9.
- ↑ 43.0 43.1 Ball, p. 100
- ↑ Horvitz, Leslie (2002). Eureka!: Scientific Breakthroughs That Changed The World. New York: John Wiley. p. 43. ISBN 978-0-471-23341-1. OCLC 50766822.
- ↑ van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. p. 19. ISBN 0444407766.
- ↑ Annales des Mines history page.
- ↑ Venable, pp. 85–86; 97
- ↑ Odling, W. (2002). "On the proportional numbers of the elements". Quarterly Journal of Science. 1: 642–648 (643).
- ↑ Scerri, Eric R. (2011). The periodic table: A very short introduction. Oxford: Oxford University Press. ISBN 978-0199582495.
- ↑ Kaji, M. (2004). "Discovery of the periodic law: Mendeleev and other researchers on element classification in the 1860s". In Rouvray, D. H.; King, R. Bruce (eds.). The periodic table: Into the 21st Century. Research Studies Press. pp. 91–122 (95). ISBN 0-86380-292-3.
- ↑ Newlands, John A. R. (18 August 1865). "On the Law of Octaves". Chemical News. 12: 83.
- ↑ Newlands, John A. R. (20 August 1864). "On Relations Among the Equivalents". Chemical News. 10: 94–95.
- ↑ Bryson, Bill (2004). A Short History of Nearly Everything. Black Swan. pp. 141–142. ISBN 978-0-552-15174-0.
- ↑ Scerri 2007, p. 306
- ↑ Brock, W. H.; Knight, D. M. (1965). "The Atomic Debates: 'Memorable and Interesting Evenings in the Life of the Chemical Society'". Isis. 56 (1). The University of Chicago Press: 5–25. doi:10.1086/349922.
- ↑ Scerri 2007, pp. 87, 92
- ↑ Kauffman, George B. (1969). "American forerunners of the periodic law". Journal of Chemical Education. 46 (3): 128–135 (132). Bibcode:1969JChEd..46..128K. doi:10.1021/ed046p128.
- ↑ Mendelejew, Dimitri (1869). "Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente". Zeitschrift für Chemie (in German): 405–406.
{{cite journal}}: CS1 maint: unrecognized language (link) - ↑ Ball, pp. 100–102
- ↑ Pullman, Bernard (1998). The Atom in the History of Human Thought. Translated by Axel Reisinger. Oxford University Press. p. 227. ISBN 0-19-515040-6.
- ↑ Ball, p. 105
- ↑ Ghosh, Abhik; Kiparsky, Paul (2019). "The Grammar of the Elements". American Scientist. 107 (6): 350. doi:10.1511/2019.107.6.350. ISSN 0003-0996.
- ↑ Atkins, P. W. (1995). The Periodic Kingdom. HarperCollins Publishers, Inc. p. 87. ISBN 978-0-465-07265-1.
- ↑ Samanta, C.; Chowdhury, P. Roy; Basu, D. N. (2007). "Predictions of alpha decay half-lifes of heavy and superheavy elements". Nucl. Phys. A. 789 (1–4): 142–154. arXiv:nucl-th/0703086. Bibcode:2007NuPhA.789..142S. CiteSeerX 10.1.1.264.8177. doi:10.1016/j.nuclphysa.2007.04.001.
- ↑ Scerri 2007, p. 112
- ↑ Kaji, M. (2002). "D. I. Mendeleev's Concept of Chemical Elements and the Principle of Chemistry" (PDF). Bull. Hist. Chem. 27 (1): 4–16. Archived from the original (PDF) on 6 జూలై 2016. Retrieved 15 అక్టోబరు 2013.
- ↑ Adloff, J-P.; Kaufman, G. B. (25 September 2005). "Francium (Atomic Number 87), the Last Discovered Natural Element". The Chemical Educator. Archived from the original on 4 జూన్ 2013. Retrieved 15 అక్టోబరు 2013.
- ↑ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. (1971). "Detection of Plutonium-244 in Nature". Nature. 234 (5325): 132–134. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0.
- ↑ Gray, p. 12
- ↑ Deming, H. G. (1923). General chemistry: An elementary survey. New York: J. Wiley & Sons. pp. 160, 165.
- ↑ Abraham, M.; Coshow, D.; Fix, W. Periodicity:A source book module, version 1.0 (PDF). New York: Chemsource, Inc. p. 3. Archived from the original (PDF) on 14 May 2012.
- ↑ Emsley, J. (7 March 1985). "Mendeleyev's dream table". New Scientist: 32–36(36).
- ↑ Fluck, E. (1988). "New notations in the period table". Pure and Applied Chemistry. 60 (3): 431–436 (432). doi:10.1351/pac198860030431.
- ↑ Ball, p. 111
- ↑ Scerri 2007, pp. 270‒71
- ↑ Masterton, W. L.; Hurley, C. N.; Neth, E. J. (2011-01-31). Chemistry: Principles and reactions (7th ed.). Belmont, CA: Brooks/Cole Cengage Learning. p. 173. ISBN 978-1-111-42710-8.
- ↑ Ball, p. 123
- ↑ Barber, R. C.; Karol, P. J.; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, E. W. (2011). "Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)". Pure Appl. Chem. 83 (7): 1485. doi:10.1351/PAC-REP-10-05-01.
- ↑ Эксперимент по синтезу 117-го элемента получает продолжение [Experiment on synthesis of the 117th element is to be continued] (in రష్యన్). JINR. 2012. Archived from the original on 1 ఆగస్టు 2013. Retrieved 15 అక్టోబరు 2013.
- ↑ Werner, Alfred (1905). "Beitrag zum Ausbau des periodischen Systems". Berichte der Deutschen Chemischen Gesellschaft. 38: 914–921. doi:10.1002/cber.190503801163.
- ↑ Scerri, Eric (2013). "Element 61 – Promethium". A Tale of 7 Elements. New York: Oxford University Press (US). pp. 175–194 (190). ISBN 978-0-19-539131-2.
... no interruptions in the sequence of increasing atomic numbers ...
{{cite book}}: CS1 maint: url-status (link) - ↑ Newell, S. B. (1980). Chemistry: An introduction. Boston: Little, Brown and Company. p. 196. ISBN 978-0-316-60455-0. Archived from the original on 28 March 2019.
- ↑ 83.0 83.1 Jensen, William B. (1986). "Classification, symmetry and the periodic table" (PDF). Comp. & Maths. With Appls. 12B (I/2). Archived (PDF) from the original on 31 January 2017. Retrieved 18 January 2017.
- ↑ Thyssen, P.; Binnemans, K. (2011). Gschneidner Jr., K. A.; Bünzli, J-C.G; Vecharsky, Bünzli (eds.). Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis. Vol. 41. Amsterdam: Elsevier. p. 76. ISBN 978-0-444-53590-0.
{{cite book}}:|journal=ignored (help) - ↑ Finding Aid to Edward G. Mazurs Collection of Periodic Systems Images. Archived from the original on 27 March 2019. Retrieved 2 October 2018.
Click on 'Finding Aid' to go to full finding aid.
{{cite book}}:|website=ignored (help) - ↑ 86.0 86.1 Scerri 2007, p. 20
- ↑ "Weird Words of Science: Lemniscate Elemental Landscapes". Fields of Science. fieldofscience.com. 22 మార్చి 2009. Archived from the original on 4 మార్చి 2016. Retrieved 4 జనవరి 2016.
- ↑ Emsely, J.; Sharp, R. (21 జూన్ 2010). "The periodic table: Top of the charts". The Independent. Archived from the original on 1 జూలై 2017.
- ↑ Seaborg, G. (1964). "Plutonium: The Ornery Element". Chemistry. 37 (6): 14.
- ↑ Mark R. Leach. "1925 Courtines' Periodic Classification". Archived from the original on 16 మే 2016. Retrieved 15 అక్టోబరు 2013.
- ↑ Mazurs, E. G. (1974). Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press. p. 111. ISBN 978-0-8173-3200-6.
- ↑ Mark R. Leach. "1996 Dufour's Periodic Tree". Archived from the original on 18 ఏప్రిల్ 2010. Retrieved 15 అక్టోబరు 2013.
- ↑ Mark R. Leach. "1989 Physicist's Periodic Table by Timothy Stowe". Archived from the original on 5 జూన్ 2012. Retrieved 15 అక్టోబరు 2013.
- ↑ Bradley, D. (20 జూలై 2011). "At last, a definitive periodic table?". ChemViews Magazine. doi:10.1002/chemv.201000107. Archived from the original on 1 మే 2013. Retrieved 15 అక్టోబరు 2013.
- ↑ Scerri 2007, pp. 285‒86
- ↑ Scerri, E. (2008). "The role of triads in the evolution of the periodic table: Past and present". Journal of Chemical Education. 85 (4): 585–589 (589). Bibcode:2008JChEd..85..585S. doi:10.1021/ed085p585.
- ↑ Alper, R. (2010). "The simplified periodic table: elements ordered by their subshells". The Journal of Biological Physics and Chemistry. 10 (2): 74–80. doi:10.4024/43AL09F.jbpc.10.02.
- ↑ 98.0 98.1 Scerri, E. (2012). "Some comments on the recently proposed periodic table featuring elements ordered by their subshells". Journal of Biological Physics and Chemistry. 12 (2): 69–70.
- ↑ Bent, H. A.; Weinhold, F. (2007). "Supporting information: News from the periodic table: An introduction to "Periodicity symbols, tables, and models for higher-order valency and donor–acceptor kinships"". Journal of Chemical Education. 84 (7): 3–4. doi:10.1021/ed084p1145.
- ↑ ఉల్లేఖన లోపం: చెల్లని
<ref>ట్యాగు;Scerri 2011అనే పేరుగల ref లలో పాఠ్యమేమీ ఇవ్వలేదు - ↑ Francl, M. (మే 2009). "Table manners" (PDF). Nature Chemistry. 1 (2): 97–98. Bibcode:2009NatCh...1...97F. doi:10.1038/nchem.183. PMID 21378810. Archived from the original (PDF) on 25 అక్టోబరు 2012. Retrieved 15 అక్టోబరు 2013.
- ↑ IUPAC (1 మే 2013). "IUPAC Periodic Table of the Elements" (PDF). iupac.org. IUPAC. Archived from the original (PDF) on 22 ఆగస్టు 2015. Retrieved 9 ఫిబ్రవరి 2020.
- ↑ Cox, P. A. (2004). Inorganic Chemistry (2nd ed.). London: Bios Scientific. pp. 149. ISBN 978-1-85996-289-3.
- ↑ Rayner-Canham, G.; Overton, T. (2006-01-01). Descriptive inorganic chemistry (4th ed.). New York: W H Freeman. pp. 203. ISBN 978-0-7167-8963-5.
- ↑ Wilson, P (2013). "Hydrogen adopts alkali metal position". Chemistry World'. Royal Society of Chemistry. Archived from the original on 12 April 2019. Retrieved 12 April 2019.
- ↑ Bodner, G. M.; Rickard, L. H.; Spencer, J. N. (1995). Chemistry: Structure and Dynamics. John Wiley & Son. p. 101location=New York. ISBN 978-0-471-14278-2.
- ↑ Seaborg, G. (1945). "The chemical and radioactive properties of the heavy elements". Chemical & Engineering News. 23 (23): 2190–2193. doi:10.1021/cen-v023n023.p2190.
- ↑ Cronyn, M. W. (August 2003). "The Proper Place for Hydrogen in the Periodic Table". Journal of Chemical Education. 80 (8): 947–951. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947.
- ↑ Greenwood & Earnshaw, throughout the book
- ↑ Lewars, Errol G. (5 డిసెంబరు 2008). Modeling Marvels: Computational Anticipation of Novel Molecules. Springer Science & Business Media. pp. 69–71. ISBN 978-1-4020-6973-4. Archived from the original on 19 మే 2016.
- ↑ Thyssen, P.; Binnemans, K. (2011). Gschneidner Jr., K. A.; Bünzli, J-C.G; Vecharsky, Bünzli (eds.). Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis. Vol. 41. Amsterdam: Elsevier. pp. 1–94. doi:10.1016/B978-0-444-53590-0.00001-7. ISBN 978-0-444-53590-0.
{{cite book}}:|journal=ignored (help) - ↑ Hevesy, G. (1929). Redkie zemeli s tochki zreniya stroeniya atoma [Rare earths from the point of view of structure of atom] (cited in Trifonov 1970, p. 188) (in Russian). Leningrad: NKhTI.
{{cite book}}: CS1 maint: unrecognized language (link) - ↑ Stewart, P. J. (2008). "The Flyleaf Table: An Alternative". Journal of Chemical Education. 85 (11): 1490. Bibcode:2008JChEd..85.1490S. doi:10.1021/ed085p1490.
- ↑ ఉల్లేఖన లోపం: చెల్లని
<ref>ట్యాగు;McGraw-Hillఅనే పేరుగల ref లలో పాఠ్యమేమీ ఇవ్వలేదు - ↑ Thyssen, P.; Binnemanns, K. (2011). "1: Accommodation of the rare earths in the periodic table: A historical analysis". In Gschneidner Jr., K. A.; Büzli, J-C. J.; Pecharsky, V. K. (eds.). Handbook on the Physics and Chemistry of Rare Earths. Vol. 41. Amsterdam: Elsevier. pp. 80–81. ISBN 978-0-444-53590-0.
- ↑ Keeler, J.; Wothers, P. (2014). Chemical Structure and Reactivity: An Integrated Approach. Oxford: Oxford University. p. 259. ISBN 978-0-19-960413-5.
- ↑ Scerri, E. (2012). "Mendeleev's Periodic Table Is Finally Completed and What To Do about Group 3?". Chemistry International. 34 (4). doi:10.1515/ci.2012.34.4.28. Archived from the original on 5 జూలై 2017. Retrieved 15 అక్టోబరు 2013.
- ↑ Castelvecchi, D. (8 ఏప్రిల్ 2015). "Exotic atom struggles to find its place in the periodic table". Nature. doi:10.1038/nature.2015.17275. Archived from the original on 5 అక్టోబరు 2015. Retrieved 20 సెప్టెంబరు 2015.
- ↑ "The constitution of group 3 of the periodic table". IUPAC. 2015. Archived from the original on 5 జూలై 2016. Retrieved 30 జూలై 2016.
- ↑ Emsley, J. (2011). Nature's Building Blocks (new ed.). Oxford: Oxford University. p. 651. ISBN 978-0-19-960563-7.
- ↑ 121.0 121.1 121.2 121.3 121.4 121.5 121.6 121.7 William B. Jensen (1982). "The Positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the Periodic Table". J. Chem. Educ. 59 (8): 634–636. Bibcode:1982JChEd..59..634J. doi:10.1021/ed059p634.
- ↑ Trifonov, D. N. (1970). Rare-earth elements and their position in the periodic system (translated from Russian). New Delhi: Indian National Scientific Documentation Centre. pp. 201–202.
- ↑ Greenwood, N. N.; Harrington, T. J. (1973). The chemistry of the transition elements. Oxford: Clarendon Press. p. 50. ISBN 978-0-19-855435-6.
- ↑ Aylward, G.; Findlay, T. (2008). SI chemical data (6th ed.). Milton, Queensland: John Wiley & Sons. ISBN 978-0-470-81638-7.
- ↑ Wiberg, N. (2001). Inorganic Chemistry. San Diego: Academic Press. p. 119. ISBN 978-0-12-352651-9.
- ↑ Wulfsberg, G. (2006). "Periodic table: Trends in the properties of the elements". Encyclopedia of Inorganic Chemistry. New York: John Wiley & Sons. p. 3. ISBN 978-0-470-86210-0.
- ↑ 127.0 127.1 Cotton, S. (2007). Lanthanide and Actinide Chemistry. Chichester: John Wiley & Sons. p. 150. ISBN 978-0-470-01006-8.
- ↑ Scerri, E. (15 సెప్టెంబరు 2015). "Five ideas in chemical education that must die – Group three". Education in Chemistry. Royal Society of Chemistry. Archived from the original on 23 డిసెంబరు 2015. Retrieved 19 సెప్టెంబరు 2015.
It is high time that the idea of group 3 consisting of Sc, Y, La and Ac is abandoned
- ↑ Jensen, W. B. (2015). "Some Comments on the Position of Lawrencium in the Periodic Table" (PDF). Archived from the original (PDF) on 23 డిసెంబరు 2015. Retrieved 20 Sep 2015.
- ↑ Xu, W-H.; Pyykkö, P. (2016). "Is the chemistry of lawrencium peculiar?" (PDF). Physical Chemistry Chemical Physics. 18 (26): 17351–17355. Bibcode:2016PCCP...1817351X. doi:10.1039/C6CP02706G. hdl:10138/224395. PMID 27314425.
- ↑ King, R. B. (1995). Inorganic Chemistry of Main Group Elements. New York: Wiley-VCH. p. 289. ISBN 978-1-56081-679-9.
- ↑ Connelly, N. G.; Damhus, T.; Hartshorn, R. M.; Hutton, A. T. (2005). Nomenclature of Inorganic Chemistry: IUPAC Recommendations 2005 (PDF). RSC Publishing. p. vii. ISBN 978-0-85404-438-2. Archived (PDF) from the original on 23 November 2018. Retrieved 26 November 2018.
Lesser omissions include ... the several different outdated versions of the periodic table. (That on the inside front cover is the current IUPAC-agreed version.)
- ↑ Leigh, G. J. (2009). "Periodic Tables and IUPAC". Chemistry International. 31 (1). doi:10.1515/ci.2009.31.1.4. Archived from the original on 27 November 2018. Retrieved 27 November 2018.
- ↑ Scerri, P.; Parsons, B. (2018). "What elements belong in group 3 of the Periodic Table?". In Scerri, E.; Restrepo, G. (eds.). From Mendeleev to Oganesson: A Multidisciplinary Perspective on the Periodic Table. New York: Oxford University Press. pp. 140–151. ISBN 978-0-190-66853-2.
- ↑ Lee, J. D. (1996). Concise inorganic chemistry (5th ed.). Oxford: Blackwell-Science. p. 679. ISBN 978-0-6320-5293-6.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "transition element".
- ↑ Xuefang, W.; Andrews, L.; Riedel, S.; Kaupp, M. (2007). "Mercury Is a Transition Metal: The First Experimental Evidence for HgF4". Angew. Chem. Int. Ed. 46 (44): 8371–8375. doi:10.1002/anie.200703710. PMID 17899620.
- ↑ 138.0 138.1 Jensen, W. B. (2008). "Is Mercury Now a Transition Element?". J. Chem. Educ. 85 (9): 1182–1183. Bibcode:2008JChEd..85.1182J. doi:10.1021/ed085p1182.
- ↑ Rayner-Canham, G.; Overton, T. (2006-01-01). Descriptive inorganic chemistry (4th ed.). New York: W H Freeman. pp. 484–485. ISBN 978-0-7167-8963-5.
- ↑ Greenwood & Earnshaw, p. 947
- ↑ Schändel, M. (2003). The Chemistry of Superheavy Elements. Dordrecht: Kluwer Academic Publishers. p. 277. ISBN 978-1-4020-1250-1.
- ↑ Yakushev, Alexander; Eichler, Robert (2016). Gas-phase chemistry of element 114, flerovium (PDF). Nobel Symposium NS160 – Chemistry and Physics of Heavy and Superheavy Elements. doi:10.1051/epjconf/201613107003. Archived (PDF) from the original on 31 March 2017. Retrieved 3 April 2018.
- ↑ Briggs, Helen (2019-01-29). "Happy birthday, periodic table" (in బ్రిటిష్ ఇంగ్లీష్). Archived from the original on 9 February 2019. Retrieved 2019-02-08.
గ్రంథములు
మార్చు- Ball, P. (2002). The Ingredients: A Guided Tour of the Elements. Oxford: Oxford University Press. ISBN 978-0-19-284100-1.
- Chang, R. (2002). Chemistry (7th ed.). New York: McGraw-Hill Higher Education. ISBN 978-0-19-284100-1.
- Gray, T. (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers. ISBN 978-1-57912-814-2.
- Greenwood, N. N.; Earnshaw, A. (1984). Chemistry of the Elements. Oxford: Pergamon Press. ISBN 978-0-08-022057-4.
- Huheey, J. E.; Keiter, E. A.; Keiter, R. L. (1993). Principles of structure and reactivity (4th ed.). New York: Harper Collins College Publishers. ISBN 978-0-06-042995-9.
- Moore, J. T. (2003). Chemistry For Dummies. For Dummies (1st ed.). New York: Wiley Publications. ISBN 978-0-7645-5430-8.
- Scerri, E. (2007). The periodic table: Its story and its significance. Oxford: Oxford University Press. ISBN 978-0-19-530573-9.
- Scerri, E. (2011). The periodic table: A very short introduction. Oxford: Oxford University Press. ISBN 978-0-19-958249-5.
- Venable, F. P. (1896). The Development of the Periodic Law. Easton, Pennsylvania: Chemical Publishing Company. OCLC 776059614.
ఇతర పఠనాలు
మార్చు- Calvo, Miguel (2019). Construyendo la Tabla Periódica. Zaragoza, Spain: Prames. p. 407. ISBN 978-84-8321-908-9.
- Emsley, J. (2011). "The Periodic Table". Nature's Building Blocks: An A–Z Guide to the Elements (New ed.). Oxford: Oxford University Press. pp. 634–651. ISBN 978-0-19-960563-7.
- Fontani, Marco; Costa, Mariagrazia; Orna, Mary Virginia (2007). The Lost Elements: The Periodic Table's Shadow Side. Oxford: Oxford University Press. p. 508. ISBN 978-0-19-938334-4.
- Mazurs, E. G. (1974). Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press. ISBN 978-0-19-960563-7.
- Rouvray, D.H.; King, R. B. (2004). The Periodic Table: Into the 21st Century. Proceedings of the 2nd International Conference on the Periodic Table, part 1, Kananaskis Guest Ranch, Alberta, 14–20 July 2003. Baldock, Hertfordshire: Research Studies Press. ISBN 978-0-86380-292-8.
- Rouvray, D.H.; King, R. B. (2006). The Mathematics of the Periodic Table. Proceedings of the 2nd International Conference on the Periodic Table, part 2, Kananaskis Guest Ranch, Alberta, 14–20 July 2003. New York: Nova Science. ISBN 978-1-59454-259-6.
- Scerri, E (n.d.). "Books on the Elements and the Periodic Table" (PDF). Retrieved 9 July 2018.
- Scerri, E.; Restrepo, G (2018). Mendeleev to Oganesson: A Multidisciplinary Perspective on the Periodic Table. Proceedings of the 3rd International Conference on the Periodic Table, Cuzco, Peru 14–16 August 2012. Oxford: Oxford University Press. ISBN 978-0-86380-292-8.
- van Spronsen, J. W. (1969). The Periodic System of Chemical Elements: A History of the First Hundred Years. Amsterdam: Elsevier. ISBN 978-0-444-40776-4.
- Verde, M. (1971). Atti del convegno Mendeleeviano: Periodicità e simmetrie nella struttura elementare della materia [Proceedings of the Mendeleevian conference: Periodicity and symmetry in the elementary structure of matter]. 1st International Conference on the Periodic Table, Torino-Roma, 15–21 September 1969. Torino: Accademia delle Scienze di Torino.
బాహ్య లంకెలు
మార్చు| Find more about Periodic table at Wikipedia's sister projects | |
| Definitions and translations from Wiktionary | |
| Media from Commons | |
| Quotations from Wikiquote | |
| Source texts from Wikisource | |
| Textbooks from Wikibooks | |
| Learning resources from Wikiversity | |
- Periodic Table featured topic page on Science History Institute Digital Collections featuring select visual representations of the periodic table of the elements, with an emphasis on alternative layouts including circular, cylindrical, pyramidal, spiral, and triangular forms.
- IUPAC Periodic Table of the Elements
- Dynamic periodic table, with interactive layouts
- Eric Scerri, leading philosopher of science specializing in the history and philosophy of the periodic table
- The INTERNET Database of Periodic Tables
- Periodic table of endangered elements
- Periodic table of samples
- Periodic table of videos
- WebElements